
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кинетика химико-технологических процессов
|
|
|
|
Мы с вами рассмотрели возможные изменения выхода целевого продукта от различных параметров, т.е. температуры, давления в системе и от концентрации реагирующих веществ. Для оптимизации химико-технологических процессов необходимо учитывать как термодинамические факторы (Т, Р, С) (температуру, давление, концентрацию), так и кинетические факторы – скорость процесса в целом.
Как известно, химико-технологические процессы состоят из физических и химических процессов. Физические и химические процессы тесно связаны, а скорость химико-технологических процессов зависит от скорости этих процессов, т.е. определяется скоростью самого медленного процесса, т.е. скоростью лимитирующей стадии.
Задачей нашего курса являются изучение схемы химических превращений, определения лимитирующей стадии процесса, а также рассмотрения возможных вариантов интенсификации процесса в целом.
Все химические превращения протекают на микро- или макроуровне. Процесс, говорят, протекает на микроуровне, когда взаимодействие реагентов осуществляется на уровне взаимодействия отдельных молекул. Примером могут служить реакции, протекающие в газовой и жидкой гомогенной системе.
Процесс взаимодействия агрегатов молекул происходит на макроуровне. В системе на макроуровне жидкость представляет собой совокупность большого числа небольших глобул, т.е. групп молекул, как бы заключенных в оболочку. Считается, что внешняя оболочка химически инертна, а единственное значение её состоит в том, чтобы сохранить условно принятую индивидуальность каждой глобулы.
В макроуровне глобулы протека ХТП процесс необходима диффузия молекул реагентов через инертную оболочку глобулы. Поэтому, при оформлении химических процессов, протекающих на макроуровне, необходимо учитывать диффузию исходных реагентов в зону реакции и продуктов реакции из зоны реакции, а также выделения и распределения тепла.
Большинство химико-технологических процессов протекает на макроуровне или промежуточном между макро и микроуровнем и для оформления реального химико-технологического процесса необходимо разрабатывать способы (методы) стадии диффузионного ограничения, т.е. найти оптимальный аэрогидродинамические условия протекания процесса, а следовательно, найти условия перевода протекания химической реакции из макроуровня на микроуровень. Когда процесс протекает на микроуровне, то говорят, что процесс протекает в кинетической области. В этом случае скорость химико-технологического процесса определяется скоростью химической реакции.
Рассмотрим, от чего же зависит скорость химических процессов, протекающих на микроуровне.
Для повышения технико-экономических показателей производства, химико-технологические процессы необходимо вести так, чтобы достигалась максимальная степень превращения (Х٭), максимальный выход продукта (Х), максимальная селективность (φ), и минимально возможное короткое время, т.е. при условии обеспечения максимальной производительности и интенсивности.
Скорость химической реакции выражается

Где n – порядок реакции
 - константа скорости реакции, выражается уравнением Аррениуса.
- константа скорости реакции, выражается уравнением Аррениуса.
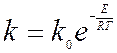
Где 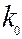 - предэкспоненциальный множитель
- предэкспоненциальный множитель
Е – энергия активации
R – газовая постоянная
Тогда подставляя значения k в уравнение скорости химической реакции получаем
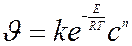
Отсюда видно, что скорость химической реакции зависит от температуры и от концентрации реагирующих веществ.
Кроме того, скорость химических реакций протекающих в фазовой фазе зависит от давления, а для каталитических процессов – от активности катализатора, тогда в общем виде зависимость скорости химических реакций запишется
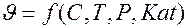
|
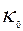 - предэкспоненциальный множитель и Е – энергию активации в уравнении Аррениуса
- предэкспоненциальный множитель и Е – энергию активации в уравнении Аррениуса
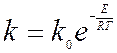
их обычно определяют экспериментально по двум значениям константы скорости, определенных при двух температурах.
Прологарифмируем уравнение Аррениуса
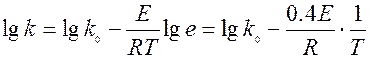
это уравнение прямой.
Строим график. Т.к. k0, Е (энергия активации) и R (газовая постоянная) – величины постоянные, то зависимость, выражаемая уравнением 

является прямолинейной зависимостью.
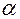
 - угол наклона
- угол наклона
Отсюда определяют Е через 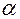
K0 – получаем значения, если продолжил прямую до пересечения с вертикальной осью.
При больших температурах, значение 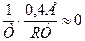 , тогда k = k0
, тогда k = k0
От чего зависит скорость ХП протекающих на микро уровне.
Для повышения ХТ пок-ей произ-во ХТП необх-мо вести так, чтобы достигалось max. Max выход продукта, max селективность и мин-е возможное короткое время. u=C1-C2/t2-t1 =DC/Dt=dC/dt=RCn. k – const скорости реакции, n – порядок реакции. k=k0e-E/RT – ур-е орениуса k0 –предэкспотенциальный множитель. е – энергия активации. u=k0e-E/RT×Cn. Отсюда видно, что скорость хим. реакции зависит от тем-ры и конц-ии. Так же скорость зависит от давления, а для каталитических процессов от активности катализатора. Тогда в общем виде: u=¦(С, Т, Р, kт).
Влияние температуры на скорость химимической реакции.
Как видно, из уравнения Аррениуса

температура входит в показатель степени, следовательно, температура должна оказывать сильное влияние на скорость химической реакции, однако это влияние не одинаково для различных типов реакции. Рассмотрим графики зависимости скорости реакции от температуры для различных типов реакций.
1. 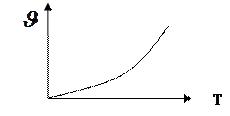 простая необратимая реакция типа
простая необратимая реакция типа
A®R ± Q при постоянной концентрации (C=const)
Строим график согласно уравнению Аррениуса.
Скорость реакции возрастает по экспоненциально-му закону.
2.  Простая обратимая экзотермическая реакция типа A®¬R+Q.
Простая обратимая экзотермическая реакция типа A®¬R+Q.
При повышении температуры скорость реакции в начале увеличивается, достигает максимального значения, а затем снижается.
Т.о. зависимость скорости от температуры V=f (T) проходит через
max
3.  Простая необратимая эндотермическая реакция типа A®¬R-Q.
Простая необратимая эндотермическая реакция типа A®¬R-Q.
При повышении температуры скорость реакции возрастает.
На показатели химико-технологического процесса температура оказывает не только положительное, но и отрицательное влияние, заключающееся в следующем:
1) увеличение потерь целевого продукта вследствие его испарения и образования побочных продуктов.
2) снижение прочности и химической стойкости материала.
3) уменьшение выхода продукта в экзотермических реакциях.
4) возможное снижение селективности сложных реакций.
Влияние концентрации реагирующих веществ на скорость химической реакции.
Возьмем реакцию
aA+bB®u1¬u2rR+sS
Суммарная скорость
 , отсюда видно, что чем выше концентрация исходного вещества, тем выше скорость реакции, однако с течением времени концентрации исходных веществ уменьшаются, а концентрации продуктов реакции увеличиваются, поэтому чтобы судить об изменении скорости реакции, строят кривые зависимости концентрации реагентов от времени С=¦(t).
, отсюда видно, что чем выше концентрация исходного вещества, тем выше скорость реакции, однако с течением времени концентрации исходных веществ уменьшаются, а концентрации продуктов реакции увеличиваются, поэтому чтобы судить об изменении скорости реакции, строят кривые зависимости концентрации реагентов от времени С=¦(t).
Рассмотрим эту зависимость для различных типов реакции.
1) Простая необратимая реакция (A®R):
Скорость необратимой реакции
-uA=-dCA/dt=kCA
После интегрирования этого уравнения в пределах изменения времени от 0 до t, концентрация CA от начального значения CAо, до CA, принимая, что k не зависит от t, получаем

 или CA = CAо е-kt =
или CA = CAо е-kt =
Отсюда видно, что по мере течения реакции, т.е. по мере увеличения времени (t) концентрация исходного вещества CA снижается, по экспоненциальному закону, соответственно уменьшается и скорость реакции.
1)Строим график для простой необратимой реакции типа A®R

Для того чтобы довести реакцию до конца необходимо длительное время процесса t, т.к. CA приближается к нулю 0. На практике реакцию не доводят до конца, ее останавливают через некоторый промежуток времени, когда концентрация исходного вещества CA > 0 больше нуля, такое время называется оптимальным.
2) для простой обратимой реакции типа A → R
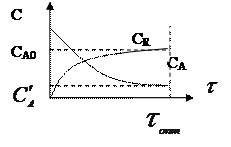
Процесс останавливается в тот момент когда концентрация исходного реагента CA достигает значения концентрации этого реагента в состоянии равновесия  . Поскольку вблизи равновесия скорость взаимодействия очень мала, процесс прекращают по достижении некоторого оптимального времени tопт, при котором разность
. Поскольку вблизи равновесия скорость взаимодействия очень мала, процесс прекращают по достижении некоторого оптимального времени tопт, при котором разность 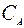 -
-  движущая сила процесса еще значительна, и, следовательно, скорость процесса достаточна высока.
движущая сила процесса еще значительна, и, следовательно, скорость процесса достаточна высока.
Из сложных реакций рассмотрим необратимые параллельные и последовательные реакции.
3) Для необратимых параллельных реакций типа A®R®S:
Скорость реакции выражается:
-uA=k1CA+k2CA=CA(k1+k2)
График имеет вид:

4) Для необратимых последовательных реакций типа A®R®N. С течением времени значение концентрации исходного вещества CA снижается, а концентрация промежуточного продукта СR вначале увеличивается, достигает некоторого max значения, а затем убывает вследствие его разложения и образования продукта N. При этом концентрации промежуточного продукта R в некоторый момент времени зависит от соотношения скоростей каждой из последовательных реакций:
Различают 3 случая:
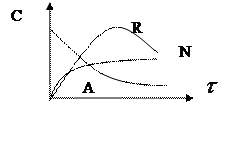 1) k1 >> k2, то при прочих равных условиях? при полном расходе продукта А образуется смесь, содержащая продукты R и N.
1) k1 >> k2, то при прочих равных условиях? при полном расходе продукта А образуется смесь, содержащая продукты R и N.
 2) k1 << k2, то промежуточный продукт R по мере его образования интенсивно расходуется, поэтому с самого начала реакции происходит накопление продукта N.
2) k1 << k2, то промежуточный продукт R по мере его образования интенсивно расходуется, поэтому с самого начала реакции происходит накопление продукта N.

3) k1» k2, то кривые зависимости CR = f(τ) и CN = f(τ) занимают промежуточное положение между кривыми, соответствующими k1 >> k2,
k1 << k2.
Гетерогенные процессы. Скорость гетерогенных процессов.
Большинство химико-технологических процессов относятся к гетерогенным. При этом огромном разнообразие гетерогенных процессов затрудняет их классификацию.
Механизм гетерогенных процессов сложнее гомогенных, т.к. реагирующие вещества находятся в различных фазах и подвод их к поверхности раздела фаз, где происходит химическое взаимодействие, а также массообмен между фазами осуществляется в результате молекулярной и конвективной диффузии, которые накладываются на основной химический процесс.
Примером гетерогенного процесса может служить процесс горения угля, который складывается из 5 стадий:
1. Внешняя диффузия О2 (через пограничный газовый слой)
2. Внутренняя диффузия О2 (через слой золы).
3. Химическая реакция.
4. Внутренняя диффузия оксида углерода СО2 (через слой золы).
5. Внешняя диффузия СО2 (через пограничный слой газа).

В любом гетерогенном химическом процессе можно выделить 3 основных, одновременно протекающих, процесса:
1) диффузия реагентов к границе раздела фаз
2) химическая реакция
3) диффузия продуктов реакций из зоны реакций.
Для установления оптимальных параметров гетерогенных процессов необходимо изучить систему в равновесии и кинетику (т.е. скорость процессов). В общем виде скорость u гетерогенного процесса выражается в следующей формуле:
u=F×DC×k
F – поверхность контакта фаз
DC – движущая сила процесса
k – коэффициент скорости процесса.
Равновесие в гетерогенных системах зависит от температуры, давления, концентрации, как исходных реагентов, так и продуктов реакций. Скорость же взаимодействия реагентов находящихся в разных фазах, зависит не только от скорости u химической реакции, но и от других факторов.
Коэффициент скорости процесса.
Коэффициент скорости процесса – зависит от многих факторов, влияющих на скорость процесса. Для определения коэффициента скорости реакции необходимо прежде всего выявить лимитирующую стадию процесса. Наиболее медленными стадиями, каждая из которых может тормозить весь процесс, являются:
1. химическая реакция,
2. диффузия,
3. одновременно химическая реакция и диффузия.
Существует несколько приемов установления лимитирующей стадии. Рассмотрим только один – зависимость скорости процессов от температуры м u=¦(t) 
Согласно закона Вант-Гоффа V1 = V2 ∙γ 
 при увеличении температуры на каждые 10°С скорость химической реакции возрастает в некоторых случаях в 2-4 раза, зависимость скорости диффузии газов от температуры в значительно меньшей степени.
при увеличении температуры на каждые 10°С скорость химической реакции возрастает в некоторых случаях в 2-4 раза, зависимость скорости диффузии газов от температуры в значительно меньшей степени.
D=a×T2 .
a – постоянный коэффициент
T – абсолютная температура
D – коэффициент диффузии.
 Из уравнения следует, что при возрастании температуры на 10°С скорость диффузии увеличивается на 3-5%. Это разное влияние температуры используют для определения лимитирующей стадии процесса.
Из уравнения следует, что при возрастании температуры на 10°С скорость диффузии увеличивается на 3-5%. Это разное влияние температуры используют для определения лимитирующей стадии процесса.
Строим график зависимости скоростей отдельных стадий от температуры
1 кривая отражает температурную зависимость скорости диффузии исходного реагента в зону реакции в соответствии с уравнением D=a×T2 (скорость диффузии).
2 кривая отражает функциональную зависимость скорости химической реакции от температуры в соответствии с уравнением Аррениуса в т. А пересекаются кривые скорости химической реакции и скорости диффузии (скорость химической реакции).
3 кривая берет свое начало при температуре, когда процесс химического взаимодействия начинает протекать с заметной скоростью (3-3΄ общая теоретическая скорость процесса).
4 кривая построена по опытным данным (общая скорость процесса, установленная экспериментально).
Химические реакторы.
Одним из основных элементов любой химико-технологической системы является химический реактор. Химический реактор – аппарат, в котором протекает химический процесс. Типичные реакторы – промышленные печи, контактные аппараты, реакторы с механическим, пневматическим и струйным перемешиванием, варочные котлы, гидраторы и т.д.
Эффективность химического процесса зависит от показателей работы реактора. Основным показателем работы реактора является интенсивность протекающего в нем процесса. Интенсивность тем выше, чем меньше время процесса. Поэтому для оптимизации работы реактора принимаем зависимость времени пребывания реагентов в реакторе от разных факторов, например, от степени превращения исходных реагентов, от начальной концентрации исходного реагента, от скорости химической реакции.
t=¦(х, с, u).
Уравнение, связывающее эти 4 параметра, является математическим описанием модели реактора и называется уравнением реактора или характеристическим уравнением.
Основные требования к промышленным реакторам.
1. Максимальная производительность и интенсивность работы.
2. Высокий выход продукта и наибольшая селективность процесса.
3. Mинимальные энергетические затраты на перемешивание и транспортировку материалов через реактор, а также наилучшее использование теплоты экзотермических реакций или теплоты, подводимой в реактор для нагрева реагирующих веществ до оптимальных температур.
4. Легкая управляемость и безопасность работы.
5. Низкая стоимость изготовления реактора и его ремонта.
6. Устойчивость работы реактора при значительных изменениях основных параметров режима (С, Т, P, u, Ак). (С – концентрация, Т – температура,
P – давление, u – скорость реакции, Ак – активность катализатора)
Классификация реакторов.
Классификация химических реакторов обычно проводят по следующим основным признакам:
1. Характер операции, протекающей в реакторе. По этому признаку делятся на: а) периодические; б) непрерывные; в) полунепрерывные.
2. Режим движения реакционной среды. По этому признаку делятся на:
а) реакторы идеального вытеснения РИВ; б) реакторы идеального смешения РИС.
3. Тепловой режим
4. Фазовое состояние реагентов.
Периодические реакторы.
Характеризуются единовременной загрузкой реагентов. Загружают определенное кол-во реагентов, которые находятся в нем до тех пор, пока не будет достигнуто желаемая степень превращения. После этого реактор загружают полностью. Характеристическое уравнение реактора периодического действия:
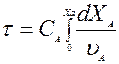
где t - время,
СAO – начальная концентрация основного исходного реагента, кМоль/м3
XA – степень превращения на входе в элементарном объеме,
 A – скорость расходования вещества А в результате реакции.
A – скорость расходования вещества А в результате реакции.
Это уравнение позволяет определить время, необходимое для достижения в реакторе заданной степени превращения. Полное время одного цикла проводимого в периодическом реакторе определяется:
tn=t+t¢всп. (сумма времени загрузки и время выгрузки)
tn – полное время,
t - время химической реакции,
t¢всп – вспомогательное время.
Реактор идеального смешения периодический (РИС-П).
Это аппарат с мешалкой, в который периодически загружается исходные реагенты. В аппарате создается интенсивное перемешивание, и концентрация реагентов в любой момент одинакова во всем объеме реактора и изменяется лишь во времени, по мере протекания химической реакции. Такое перемешивание считают идеальным, а реактор – реактором идеального смешения.
|

NАО – начальное количество исходного реагента А в смеси,
САО – начальная концентрация реагента А в смеси,
ХАО – начальная степень превращения реагента А.
Изменение концентрации исходного реагента А от времени и в объеме будет иметь вид:

 - время, Y – пространственная координата.
- время, Y – пространственная координата.
Уравнение реактора идеального смешения периодический РИС-П записывается следующим образом:
t=СAO∫dXA/k×CAn,
где k-константа скорости;
n – порядок реакции (уравнение решают в зависимости от n);
ХА – степень превращения.
САО – начальная концентрация
Реактор идеального вытеснения - РИВ –
РИВ - трубчатый аппарат, достаточно большой длины и малого диаметра. В реактор непрерывно подаются исходные реагенты, которые превращаются в продукты реакции по мере перемешивания их по длине реактора.
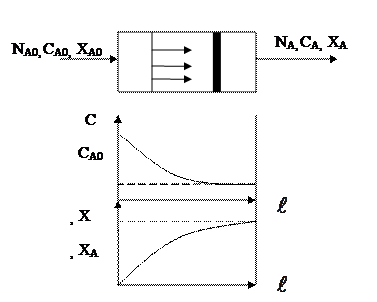
Каждый элемент объема реакционной массы dV движется по длине реактора, не перемешиваясь с движущийся впереди и сзади элементами объема; так же отсутствует перемешивание по сечению реактора. Этот объем ведет себя как поршень в цилиндре, поэтому такой режим движения называется поршневымрежимом полного вытеснения.
В этом случае отсутствует продольное и поперечное сечение. Время пребывания всех частиц в аппаратах идеального вытеснения одинаково, т.е. временной характеристикой РИВ служит следующее уравнение:
t¢=t=u/VC
где t¢ - время пребывания в реакторе любого элементарного объема (частицы).
t - среднее время пребывания.
u - реакционный объем
VC – расход смеси.
Уравнение РИВ одинаково с уравнением РИС-П, т.е.:
t=СAO∫dXA/k×CAn
Реальные реакторы.
Обычно работают при режимах неполного перемешивания, но в некоторых производственных реакторах степень перемешивания столь незначительна, что для технологических расчетов можно принять модель идеального вытеснения.
К таким реакторам относятся прежде всего трубчатые контактные аппараты с катализаторами в трубах или в межтрубном пространстве служащие для гетерогенных газовых реакций.
Трубчатые реакторы, типа кожухотрубного теплообменника применяется и для гомогенных газовых реакций.
В реальном реакторе гидродинамическая обстановка отличается от гидродинамики идеального реактора.
В реальном реакторе кроме поршневого движения потока наблюдается продольное перемешивание, и модель реактора усложняется. Степень отклонения реактора от идеального зависит от коэффициента продольного перемещения конвективной диффузии (DL), линейной скорости потока (W) и длины реактора (l). Они сведены в безразмерный комплекс:
DL/W×l,
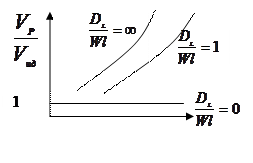 что показывает степень отклонения реального реактора от идеального, и связан соотношением объемов реального и идеального реакторов, необходимых для достижения одинаковой степени превращения (ХА). Эта зависимость выражается графиком:
что показывает степень отклонения реального реактора от идеального, и связан соотношением объемов реального и идеального реакторов, необходимых для достижения одинаковой степени превращения (ХА). Эта зависимость выражается графиком:
В общем виде эта зависимость выражается так:
Vp/Vид=¦(DL/W×l; XA)
Реактор идеального смешения непрерывный (РИС-Н)
Представляют собой аппарат с мешалкой, в котором непрерывно подаются реагенты, и непрерывно из него отводятся продукты реакции.
|

В РИС-Н считается, что реакционная смесь мгновенно перемешиваются во всем объеме реактора, т.е. концентрация исходного реагента становится одинаковой во всем объеме. Она будет тем ниже, чем больше время пребывания, следовательно, степень превращения и скорость реакции будет одинаковой во всем объеме реактора. Изменение параметров процесса в реакторе идеального смешения графически изображается следующим образом:
|

Как видно из графиков для РИС-Н характерным признаком является отсутствие градиента параметров как во времени, так и в объеме реактора, поэтому уравнение материального баланса составляют сразу для реактора в целом.
Время пребывания реагентов определяется:

В реальном реакторе смешения реакционная смесь перемещается не мгновенно как в РИС-Н, а постепенно, поэтому концентрация исходного реагента в объеме реактора не одинакова, т.е. функция СА=f(y) – не прямолинейна. Отклонение реального реактора от идеального выражается по формуле:
 (δ – дельта)
(δ – дельта)
где τр, τид – условное время пребывания реакционной смеси для достижения заданной степени превращения (ХА) в реальном и идеальном реакторе.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1459; Нарушение авторских прав?; Мы поможем в написании вашей работы!