
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ультраструктурная патология клетки
|
|
|
|
ЛЕКЦИИ ПО ПАТАНАТОМИИ
СОДЕРЖАНИЕ
1. Ультраструктурная патология клетки……………………………………………………………………………………
2. Повреждения. Паренхиматозные дистрофии……………………………………………………………………………
3. Стромально – сосудистые дистрофии……………………………………………………………………………………
4. Смешанные дистрофии…………………………………………………………………………………………………….
5. Некроз, аптоз и атрофия……………………………………………………………………………………………………
6. Нарушения кровообращения………………………………………………………………………………………………
7. Компенсаторно-приспособительные процессы………………………………………………………………………….
8. Воспаление………………………………………………………………………………………………………………….
9. Иммунитет…………………………………………………………………………………………………………………
10. Аномалии иммунного ответа…………………………………………………………………………………………….
11. Общее учение об опухолях……………………………………………………………………………………………….
12. Эпителиальные опухоли…………………………………………………………………………………………………..
13. Неэпителиальные опухоли………………………………………………………………………………………………..
14. Раки важнейших локализаций……………………………………………………………………………………………
15. Опухоли из кроветворной ткани…………………………………………………………………………………………
16. Болезни ССС……………………………………………………………………………………………………………….
17. Ревматические заболевания. Неревматические эндокардиты………………………………………………………….
18. Болезни органов дыхания………………………………………………………………………………………………….
19. Болезни органов пищеварения…………………………………………………………………………………………….
20. Болезни почек……………………………………………………………………………………………………………….
21. Пренатальная паталогия…………………………………………………………………………………………………….
22. Перинатальная паталогия…………………………………………………………………………………………………..
23. Экологическая паталогия……………………………………………………………………………………………………
24. Инфекционные заболевания………………………………………………………………………………………………..
25. Прионовые инфекции……………………………………………………………………………………………………….
26. Вирусные инфекции………………………………………………………………………………………………………...
27. ОРВИ………………………………………………………………………………………………………………………..
28. Прочие вирусные инфекции……………………………………………………………………………………………….
29. Риккетсиозы…………………………………………………………………………………………………………………
30. Бактериальные инфекции……………………………………………….............................................................................
31. Кишечные инфекции………………………………………………………………………………………………………..
32. Карантинные инфекции…………………………………………………………………………………………………….
33. Воздушно-капельные инфекции……………………………………………………………………………………………
34. Висцеральные микозы………………………………………………………………………………………………………
35. Инфекционные болезни, вызываемые простейшими……………………………………………………………………..
ЛЕКЦИЯ № 1
Актуальность темы
Благодаря работам Рудольфа Вирхова, великого немецкого ученого, одного из основоположников современной патологической анатомии, в настоящее время не осталось болезней, знания о которых не базировались бы на морфологическом изучении клеток – структурных единиц живых организмов. Однако увидеть нормальную структуру клетки во всех ее модификациях удалось только во второй половине этого века, благодаря применению ультраструктурного метода изучения клеток с использованием трансмиссионной (просвечивающей) и сканирующей электронной микроскопии, криоскалывания, электронной гисто- и иммуногистохимии, электронной ауторадиографии.
При изучении курса общей гистологии Вами получены необходимые сведения о нормальных ультраструктурах и их функциональной роли в жизнедеятельности эукариотической животной клетки (в дальнейшем просто "клетки").
Напомню, что клетка – это высокоорганизованная, саморегулирующаяся структурно-функциональная единица живого организма, способная к активному обмену с окружающей ее средой.
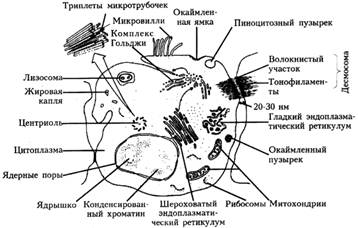
Рис.1. Схема строения клетки
В клетке человека и животных выделяют следующие ультраструктуры:
- ядро (оболочка с ядерными порами, кариоплазма, ядрышки и перинуклеарное пространство);
- цитоплазма: гиалоплазма с различными органеллами и включениями:
1. Органеллы мембранного происхождения:
§ цитоплазматическая мембрана (включая десмосомы);
§ митохондрии: (наружная оболочка, кристы, матрикс);
§ аппарат Гольджи;
§ эндоплазматический ретикулум:
§ гладкий;
§ гранулярный (шероховатый);
§ лизосомы: первичные, вторичные: цитолизосомы и фаголизосомы; остаточные тельца или телолизосомы.
2. Органеллы немембранного происхождения:
§ свободные рибосомы и полисомы;
§ центросома (центриоль);
§ микротрубочки или макрофиламенты;
§ специализированные структуры или микрофиламенты (нейрофибриллы, миофибриллы – гладкие и поперечные, тонофибриллы, фибриллы промежуточных типов, микроворсинки, реснички, жгутики).
3. Включения: трофические, секреторные вакуоли, пинозитозные пузырьки.
Кажущиеся в световом и электронном микроскопе неизменными внутриклеточные структуры, при жизни не являются статичными. В процессе жизнедеятельности клетки происходит постоянное их обновление. Однако эти изменения не всегда доступны для распознавания в электронном микроскопе и определить их можно лишь на молекулярном уровне при помощи специальных методик молекулярной морфологии.
Повреждение отдельных ультраструктур и даже гибель отдельных клеток, из которых построены различные ткани и органы человека, может быть проявлением "физиологической нормы". Это постоянный, "запрограммированный" процесс гибели клеток в организме, обозначаемый апоптозом, имеет очень важное значение не только для нормального существования организма, но и играет одну из ключевых ролей при многих общепатологических процессах.
Воздействие тех или иных внутренних и/или внешних факторов приводит на начальном этапе к повреждению элементарных структур клетки и нарушению их функций, в дальнейшем возможно развитие как патологии отдельной клетки, так и клеточных коопераций. Патология клетки, или "целлюлярная патология" – это структурная основа всей патологии человека.
Многочисленными исследованиями доказано, что любой патологический процесс, какой бы степенью функциональных нарушений он не проявлялся, начинается на уровне ультраструктур, то есть субклеточном уровне. Не существует ни одного повреждающего фактора, который не приводил бы к структурным изменениям. Ряд заболеваний может быть и был впервые диагностирован только на ультраструктурном уровне. Важно отметить, что самые ранние, начальные стадии патологического процесса, проявляющиеся только на уровне ультраструктур клеток, как правило, обратимы или могут быть компенсированы.
Знание клеточной патологии помогает специалисту любого медицинского профиля понимать морфологическую сущность того или иного патологического процесса, происходящего в тканях и органах, расширяя представления о причинах и механизмах возникновения болезни, особенностях ее течения, позволяет определить и наметить рациональные и эффективные пути их лечения и профилактики. Все вышеперечисленное определяет важность и актуальность темы.
Цель обучения – уметь распознавать количественные и качественные морфологические изменения ультраструктур клетки, обусловленные воздействием различных патогенных факторов и интерпретировать функциональное значение этих изменений.
Для этого необходимо уметь:
- идентифицировать на электронных микрофотографиях отличительные морфологические признаки органелл клетки в условиях патологии;
- определять характер и степень структурных отклонений изучаемых органелл от эталонов, принятых в качестве "нормальных" морфологических констант;
- определять обратимость и необратимость выявленных структурных изменений органелл;
- распознавать стереотипные и специфичные изменения ультраструктур клетки в ответ на воздействие болезнетворного фактора;
- интерпретировать морфологические изменения ультраструктур и определить их функциональное значение в развитии общих реакций клетки при различных общепатологических процессах, таких как, например, нарушения метаболизма клетки, смерть клетки (апоптоз и некроз), гипертрофия и атрофия клетки, клеточная дисплазия и метаплазия, опухолевая трансформация и др.
Нормальное функционирование клетки зависит от:
1. Состояния окружающей клетку среды (гомеостаза);
2. Своевременности и достаточности поступления в клетку питательных веществ (кислорода, глюкозы, аминокислот);
3. Уровня содержания продуктов метаболизма, особенно, CO2.
Поскольку в большинстве случаев воздействие любого патогенного (болезнетворного) фактора сопровождается изменением гомеостаза, то рецепция патогенной информации будет осуществлена клеткой через ее клеточную мембрану.
Плазматическая мембрана ограничивает полость, внутри которой помещаются клеточные компоненты. Некоторые органеллы, такие, как комплекс Гольджи, напрямую связаны с поверхностью мембраны; другие, например, эндоплазматический ретикулум (шероховатый и гладкий), непосредственно с плазматической мембраной не контактируют.
Плазматическая мембрана построена одновременно и как барьер и как проход для всех субстанций, которые проникают в клетку или ее покидают. Она поддерживает внутренний химический состав клетки посредством избирательной проницаемости и транспортировки. Процесс мембранного транспорта предполагает перенос ионов и других субстратов против градиента концентрации. Транспорт может быть активным, тогда он требует АТФ и "подвижности" транспортных белков в мембране, или пассивным, посредством различных диффузионных и обменных процессов. Вода и ионы пересекают ее путем простой диффузии. Такие молекулы, как глюкоза, нуждаются в средствах транспортировки.
Нормальная проницаемость цитомембраны – главное условие в гомеостазе клетки.
Поэтому изучение ультраструктурной патологии клетки мы начнем с изучения структурных изменений, наблюдаемых в клеточной мембране.
ЦИТОПЛАЗМАТИЧЕСКАЯ МЕМБРАНА
Границы клеточной мембраны схематически обычно изображают в виде тонкой линии. В трансмиссионном электронном микроскопе она представляется трехслойной структурой, состоящей из двух плотных листков, каждый толщиной от 2 до 3 нм, разделенных менее плотным интермедиарным слоем, толщиной от 4 до 5 нм. Общая толщина мембраны составляет от 7,5 до 10 нм. Наружная поверхность ее представлена толстым слоем мукополисахаридов (гликокаликс). Внутренняя поверхность связана с элементами цитоскелета клетки и сформирована лабильными белками, которые обеспечивают целостность микрофиламентов и микротрубочек. На поверхности мембраны некоторых клеток имеются микроворсины, которые по оси заполнены молекулами актина, а также десмосомы (клеточные соединения), в которых содержатся микрофиламенты, образованные кератином.
Davson и Danielli в 1935 году предложили модель клеточной мембраны. Главная изюминка модели – характер расположения молекул липидов. Мембрана состоит из двух рядов молекул фосфолипидов, расположенных более или менее перпендикулярно к поверхности мембраны, так что их неполярные (гидрофобные) концы соприкасаются друг с другом, а полярные (гидрофильные) обращены к водным растворам по ту или другую сторону мембраны (рис. 2)

Рис.2 Схема строения клеточной мембраны
Нормальная проницаемость цитомембраны – главное условие в гомеостазе клетки. Цитомембрана построена одновременно и как барьер, и как проход для всех субстанций, которые проникают в клетку или ее покидают. Она поддерживает внутренний химический состав клетки посредством избирательной проницаемости и транспортировки. Процесс мембранного транспорта предполагает перенос ионов и других субстратов против градиента концентрации. Транспорт может быть активным, тогда он требует АТФ и "подвижности" транспортных белков в мембране, или пассивным, посредством различных диффузионных и обменных процессов. Вода и ионы пересекают ее путем простой диффузии. Такие молекулы, как глюкоза, нуждаются в средствах транспортировки.
В цитомембране располагаются рецепторы гормонов, таких как инсулин или адреналин, и других биологически активных веществ, влияющих на функцию и реактивность клеток, локализуются различные протеины, молекулы мукополисахаридов и специфические белки (например, антигенные детерминанты гистосовместимости), которые определяют ее способность к проницаемости и антигенные свойства.
Цитомембрана играет главную роль в межклеточных коммуникациях как путем образования специализированных межклеточных контактов, так и путем передачи сигналов.
Наконец, она играет критическую роль в росте и пролиферации клеток. Предполагают, что патологические модификации в цитомембране ответственны за опухолевую трансформацию клеток.
НАРУШЕНИЯ СТРУКТУРЫ И ФУНКЦИИ МЕМБРАНЫ КЛЕТКИ
Причины повреждения цитоплазматической мембраны:
1. Образование свободных радикалов (очень нестабильных частиц с нечетным числом электронов на внешней орбите), содержащих активированный кислород, с последующей реакцией между ними и липидами мембраны клетки (перекисное окисление липидов) (табл. 1), в результате чего освобождается избыточная энергия.
2. Активация системы комплемента. Комплемент – это система плазматических белков (C1-C9), которые существуют в неактивной форме и составляют приблизительно 10% глобулинов крови (см. Иммунитет). При активации его конечные продукты, вероятно комплексы C5b, C6, C7, C8 и C9 проявляют фосфолипазную активность, то есть могут ферментативно повреждать цитомембрану. Это явление (фиксация комплемента и его активация) – важный компонент иммунного ответа, при котором уничтожаются клетки, распознанные как "чужие".
3. Лизис ферментами. Например, панкреатические липазы (в избытке выделяются при остром панкреатите) и ферменты, вырабатываемые Clostridium perfringens (один из возбудителей газовой гангрены) вызывают обширный некроз цитомембран.
4. Лизис вирусами осуществляется как путем прямой вставки цитопатических вирусов в мембрану клетки, так и косвенно, через иммунный ответ на вирусные антигены, расположенные на поверхности инфицированных клеток.
5. Действие физических и химических факторов (высокая и низкая температура, химические вещества и др.)
Таблица 1
Свободные радикалы и повреждение клетки
| Образование свободных радикалов Ионизирующее излучение Химические окислители Канцерогены Оксигенотерапия Острое воспаление (гранулоциты) Ксантиноксидаза Химические яды (например, четыреххлористый углерод) | Свободные радикалы Супероксид (О2°) Гидроксил (ОН°) Пергидроксил (ОН2°) Перекись водорода (Н2О2) CCl3° радикал | Действие свободных радикалов Перекисное окисление липидов клеточной поверхности и митохондриальной мембраны Инактивация тиоловых ферментов Разрыв нитей ДНК |
| Клеточные антиоксидантные системы | ||
| Глутатионпероксидаза Каталаза Пероксиддисмутаза Витамин Е (альфа-токоферол) Витамин С |
В левой колонке представлены факторы, при действии которых возникают свободные радикалы, представленные в средняя колонке вверху. Механизмы повреждения перечислены в правой колонке. Нормальная клетка имеет несколько антиоксидантных механизмов, инактивирующих свободные радикалы, которые представлены в средней колонке внизу.
Результаты повреждения цитоплазматической мембраны:
1. Потеря структурной целостности, вплоть до некроза. Ограниченное (локальное) повреждение может быть восстановлено, однако с некоторой потерей мембраны. В эритроцитах этот процесс ведет к формированию микросфероцитов.
2. Нарушение "барьерной" функции, что может привести к избыточному поступлению воды в клетку – вакуольной или гидропической дистрофии.
Виды повреждений цитоплазматической мембраны
Патология мембран клетки может сопровождаться изменениями проницаемости мембран, нарушениями мембранного транспорта, коммуникации клеток и их "узнавания", изменениями подвижности мембран и формы клеток, нарушениями синтеза и обмена мембран.
Повреждение формы мембран. Морфологически проявляется в виде деформации или атрофии специализированных структур, появлением щелей или разрывов. Например, атрофия микровиллей энтероцитов при заболеваниях тонкой кишки с развитием синдрома мальабсорбции или деформация ножек подоцитов эпителия внутреннего листка капсулы Боумена почечного клубочка при некоторых нефропатиях.
Изменения проницаемости мембран. Важная роль в осуществлении проницаемости мембран принадлежит гликокаликсу и взаимодействию мембранных белков с цитоскелетом, а также гормонам, взаимодействующим с мембранными рецепторами. Изменения проницаемости могут быть тяжелыми (необратимыми) или поверхностными. Наиболее изученной моделью изменения мембранной проницаемости является повреждение тяжелыми металлами (ртуть, уран). Тяжелые металлы резко увеличивают проницаемость мембраны для натрия, калия, хлора, кальция и магния, что приводит к быстрому набуханию клеток, распаду их цитоскелета. Увеличение поверхности клеточной мембраны за счет мембран микропиноцитозных пузырьков является признаком резкого набухания клетки и ее гибели. Увеличение объема клетки за счет поступления большого количества воды в связи с аномалией осмотического давления сопровождается появлением щелей и даже разрывов в мембране. Если разрывы не увеличиваются, то щели закрываются и исчезают. Утолщение клеточной мембраны может быть связано с уменьшением количества ионов кальция во внеклеточной жидкости. При этом изменяется проницаемость мембраны для ионов натрия и калия и в клетке накапливается жидкость.
Изменения коммуникации клеток и их "узнавания". Коммуникабельность клеток и распознавание "своих" и "чужих" – необходимое свойство клеточного кооперирования. Клеточные "общение" и "узнавание" прежде всего базируются на различиях в структуре внешних поверхностей плазматических мембран. Особую роль в этих процессах играет гликокаликс мембраны с поверхностными антигенами – маркерами определенного типа клеток. Поверхностные антигены могут изменяться. Изменения клеточного "общения" и "узнавания" встречаются при различных патологических процессах (воспаление, регенерация, опухолевый рост). Показано, что при исчезновении характерных для данного типа клеток антигенов могут появляться "эмбриональные" и аномальные (например, карциноэмбриональный) антигены. Изменения гликопротеидов (гликокаликса) мембраны делают ее более доступной действию антител. Цитоплазматическая мембрана принимает участие в иммунных процессах. На ее поверхности могут фиксироваться антитела и здесь же может проявляться антиген-антительный конфликт. Наличие комплексов антиген-антитело может быть выявлено при помощи люминесцентной микроскопии или в сканирующем электронном микроскопе.
Избыточное увеличение нормальных структур. Действие на мембрану клетки агрессивного фактора вызывает ответные (реактивные) морфологические изменения в виде увеличения количества, протяженности и площади мембранных структур. Захват клеткой различных чужеродных субстанций (жидких и плотных) может осуществляться при помощи двух механизмов: пиноцитоза и фагоцитоза.
Пиноцитоз (рinein – пить) – инвагинация (впячивание) наружной клеточной мембраны с захватом инородной жидкой субстанции, последующим смыканием мембраны, отшнуровкой ее и образованием пиноцитозного пузырька. Этот процесс наблюдается в большинстве клеток. Нередко пиноцитозные пузырьки играют роль транспортного средства для жидкостей, пересекающих таким образом иногда всю клетку (например, в эндотелии).
Фагоцитоз (phagein – поедать) представляет собой процесс захватывания клеткой извне и втягивания в себя какой-либо плотной частицы путем эвагинации (выпячивания) клеточной мембраны и формирования фагоцитозного пузырька.
Судьба фаго- и пиноцитозных пузырьков в большинстве случаев одинакова: сливаясь в цитоплазме клетки с первичными лизосомами они формируют мультивезикулярные тельца (при пиноцитозе) или фагосомы (при фагоцитозе). И те, и другие называют вторичными лизосомами. Во вторичных лизосомах осуществляется процесс переваривания захваченных частиц с образованием остаточных телец, которые затем выталкиваются из клетки наружу путем экзоцитоза (ехо – вне). Ампутацию отростков цитоплазмы и высвобождение поврежденных фрагментов внутриклеточных структур принято называть клазматозом (clastein – повреждать).
Появление специальных патологических структур. Клеточный ответ на аноксию, антиген-антительный конфликт или на ингибиторы метаболизма проявляется своеобразным изменением клеточной мембраны в виде формирования миелиноподобных, или псевдомиелиновых структур. Они появляются в результате перекисного окисления липидов мембран и формируются из высвобождающихся фосфолипидов путем скручивания удлиненных цитоплазматических отростков или микротрубочек. Не следует путать псевдомиелиновые фигуры и специфические миелиновые фигуры, связанные с миелином. Последние вакуолизируются и фрагментируются в случаях демиелинизации или повреждении нейронов.
Альтерация клеточных соединений. В мембране клетки имеются различные типы контактов, сравнимых с электрическими соединениями. Они могут быть представлены комплексами сильных (интермедиарных) или слабых (десмосомы, интердигитирующие соединения) межклеточных контактов.
Патология межклеточных контактов может проявляться в их сохранении в тех случаях, когда они обязаны были исчезнуть в процессе созревания клетки: например, в эпидермисе при паракератозе (задержке созревания и слущивания клеток). В других случаях наблюдается распад тех клеточных соединений, которые должны существовать в норме. При этом клетки утрачивают связь друг с другом. Это состояние может быть вызвано уменьшением количества ионов кальция во внеклеточной жидкости или воздействием на клеточную мембрану фосфолипаз. Разделенные клетки обладают утолщенной плазматической мембраной. Альтерация клеточных контактов закономерно наблюдается в процессе канцерогенеза, лежит в основе нарушения контактного торможения пролиферации опухолевых клеток, способствует опухолевой инфильтрации и метастазированию.
ЦИТОПЛАЗМА
Цитоплазма в световом микроскопе при окраске гематоксилином и эозином ацидофильна, выглядит оптически однородной или мелкогранулированной. В электронном микроскопе определяются многочисленные структуры (органеллы), необходимые для метаболизма клетки. В части клеток в условиях патологии содержатся образования, не участвующие в метаболических процессах и не являющиеся структурно однородными с цитоплазмой – это включения (жир, гликоген, пигменты и др.)
МИТОХОНДРИИ
Митохондрии – это структуры, ограниченные двумя мембранами – наружной и внутренней, имеющие форму цилиндра диаметром 0,5-1 нм и длиной 2-5 нм. Число, форма и величина митохондрий широко варьируют в различных клетках.
Митохондрии – это индикаторы функционального состояния клеток, наиболее чувствительные к агрессии. Известно, что одним из первых признаков аутолиза (гибели) клетки является вакуолизация митохондрий. Хотя митохондрии и относятся к стабильным структурам, в клетках происходит их постоянное обновление. Деструкция (разрушение) избыточного числа митохондрий осуществляется при помощи процессов аутофагии вакуолями, которые играют роль вторичных лизосом.
Митохондрии – это “энергетические станции”, которые непосредственно участвуют в обмене через цикл Кребса и системы транспорта электронов дыхательной цепи. Производимая ими энергия конвертируема и накапливается внутри молекул АТФ в виде богатых энергией фосфатных соединений (макроэргических связей). АТФ производится фосфорилированием АДФ; эта реакция связана с окислением восстановленных веществ в дыхательной цепи ферментов. Для этого требуется кислород.
ПОВРЕЖДЕНИЯ МИТОХОНДРИЙ
Причины повреждения (альтерации) митохондрий, связанные с нарушением производства АТФ (рис. 3).

| Рис.3 Основные биохимические процессы, участвующие в продукции АТФ. Нарушения, которые вызывают повреждение синтеза АТФ обозначены буквами, описание смотри в тексте. |
1. Гипогликемия: Глюкоза – главный субстрат для производства энергии в большинстве тканей и единственный источник энергии в клетках головного мозга – нейронах. Поэтому низкий уровень глюкозы в крови (гипогликемия) приводит к недостаточному производству АТФ, которое является наиболее ощутимым в мозге.
2. Гипоксия: Недостаток кислорода в клетках (гипоксия) может возникать при:
1. Наличии механической преграды для дыхания или болезней легких, которые сопровождаются нарушением оксигенации крови.
2. Ишемии, или нарушении притока артериальной крови к тканям в результате общих нарушений циркуляции или возникновения местной преграды для тока крови.
3. Анемии (то есть, при снижении количества эритроцитов и/или уровня гемоглобина в крови), что приводит к снижению транспорта кислорода кровью.
4. Нарушении структуры гемоглобина (например, при отравлении угарным газом (СО), при котором образуется карбоксигемоглобин, не способный к переносу кислорода).
3. Ингибирование ферментов: например, отравление цианистым калием. Цианистый калий ингибирует цитохромоксидазу, конечный фермент в дыхательной цепи, что приводит к острому дефициту АТФ во всех клетках органов и быстрой смерти.
4. Разобщение окислительного фосфорилирования: разобщение окисления и фосфорилирования происходит или путем химических реакций, или путем физического отделения ферментов от митохондриальной мембраны. Митохондриальное набухание, которое является общим признаком для большинства типов повреждений, является причиной разобщения окислительного фосфорилирования.
Виды повреждений митохондрий
Различают следующие структурные изменения митохондрий (рис. 4):
- увеличение числа и размеров;
- образование мегамитохондрий;
- изменение формы;
- изменения структуры крист митохондрий.
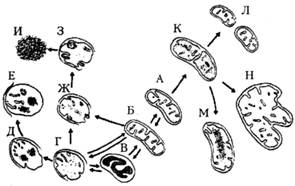
Рис.4. Схема повреждений митохондрий.
A – нормальная митохондрия; Б – дегрануляция митохондриального матрикса; В – сжатие и уплотнение митохондриального матрикса; Г – увеличение объема, фрагментация крист и разрыв наружной мембраны; Д – конденсация разрушенного материала; Е – образование трубочек; Ж и З – накопление пластинчатых крист, контактирующих с внутренней мембраной; И – кальцификация митохондрий; К – начало деления митохондрий: разделение перегородкой на две части; Л – полное деление митохондрий; М – паракристаллические включения; Н – мегамитохондрия (двойной стрелкой показаны обратимые изменения).
Увеличение числа и размеров митохондрий. Избыточное увеличение числа митохондрий можно наблюдать в оптическом микроскопе. Это проявляется появлением в цитоплазме клеток оксифильных гранул. Такие клетки известны как онкоциты или, например, в щитовидной железе, как клетки Гюртля. Они имеют обильную цитоплазму, ядро в них часто отодвинуто к периферии. Онкоциты выявляются часто в щитовидной, паращитовидных, слюнных, бронхиальных и молочных железах. В секретирующих клетках онкоцитарная трансформация свидетельствует об изменении белкового синтеза. Клетки, цитоплазма которых богата митохондриями, встречаются и при других патологических состояниях (гипертрофия, воспаление, опухоли).
Мегамитохондрии. Митохондрии способны к ауторепликации как пластиды (аналог митохондрий) растительных клеток. Они могут расти и делиться, достигать гигантских размеров, иногда больше чем ядро – это и есть мегаметахондрии. В световом микроскопе их можно увидеть в виде светлых круглых, очень оксифильных шариков. Мегамитохондрии встречаются, например, в гепатоцитах при алкоголизме и при циррозах печени, в эпителиальных клетках канальцев почек при нефротическом синдроме, при дефиците рибофлавина, при интоксикации бромидами, при некоторых мышечных заболеваниях. Однако, известно и то, что после устранения интоксикации уже через несколько часов происходит возврат к норме гигантских митохондрий.
Изменение формы митохондрий чаще всего обусловлено их набуханием.
Набухание митохондрий. Оно связано с проникновением в митохондрию воды. Набухание необходимо дифференцировать от истинного увеличения объема митохондрий, известного под названием мегамитохондрии (см. ниже). Набухание митохондрий наблюдается при самых различных состояниях: голодании, гипоксии, интоксикациях, лихорадке, мышечных заболеваниях, назначении тироксина и т.д. Мутное набухание, описанное в оптическом микроскопе как зернистая дистрофия клетки, также сопровождается набуханием митохондрий.
In vitro констатировано два типа набуханий.
Первый тип – с малой амплитудой набухания, при котором изменение энергетической активности влечет за собой обратимую альтерацию протеиновых структур. Этот тип набухания сопровождается пассажем воды через расширенное наружное пространство, сформированное наружной мембраной, во внутреннее, образованное кристами и выполненное матриксом. При этом митохондриальный матрикс сжимается и становится очень плотным. После фазы контракции митохондрии могут возвращаться в нормальное состояние.
Второй тип – с большой амплитудой набухания, возникает в результате увеличения проницаемости внутренней мембраны. Следствием этого является разглаживание и фрагментация крист. Набухание с большой амплитудой вначале может корригироваться увеличением концентрации АТФ и магнезии, но после повреждения наружной мембраны быстро становится необратимым (т.е. смертельным). Оно сопровождается in vivo гибелью гранул митохондриального матрикса, которые вначале просветляются, затем уплотняются и образуют хлопья во внутренней камере. Заключительный этап гибели характеризуется тем, что обе мембраны, внутренняя и наружная, разрываются.
При некоторых состояниях на внутренней мембране могут образовываться преципитаты фосфата кальция, что ведет к кальцификации (омелотворению) митохондрий. Эти изменения также являются необратимыми.
Изменения структуры крист митохондрий могут касаться их размеров, формы и числа:
- деформация крист и уменьшение их числа (встречается при пониженной активности митохондрий);
- увеличение числа крист митохондрий – свидетельство возрастающих функциональных потребностей клетки.
Наряду с изменением крист в условиях патологии, наблюдается изменение структуры плотных гранул митохондриального матрикса. Эти гранулы диаметром от 20 до 50 нм аккумулируют дивалентные катионы. Кроме кальция, магния, фосфора и других неорганических субстанций, матрикс плотных гранул образован протеинами и липидами. Их увеличение в объеме наблюдается в клетках, перенасыщенных ионами кальция, что может вести к смертельному повреждению клетки. Гипертрофия (увеличение в объеме) этих гранул выявлена при ишемии миокарда, в гепатоцитах при интоксикации четыреххлористым углеродом, в мышечных клетках при тетанусе. Уменьшение или исчезновение плотных гранул происходит в онкоцитах, гепатоцитах и клетках кишечного эпителия при ишемии.
ЭНДОПЛАЗМАТИЧЕСКИЙ РЕТИКУЛУМ
Эндоплазматический ретикулум (ЭР) в цитоплазме образует многочисленные сплетения из щелей и каналов. Он участвует в формировании ядерной мембраны и аппарата Гольджи. Функция мембран, формирующих ретикулум, различна в зависимости от их связи с рибосомами: "шероховатый ЭР"– это место белкового синтеза, составляющего основу клеточной секреции белка, тогда как "гладкий ЭР" играет роль в синтезе углеводов, метаболизме стероидов и различных токсических субстанций, которые необходимо нейтрализовать. Он также имеет отношение к метаболизму гликогена. Развитость ЭР является выражением синтетической активности, что можно наблюдать в экзокринных клетках поджелудочной железы или плазмоцитах, однако накопление продуктов синтеза в ЭР может быть обусловлено замедлением их экскреции. Примером этого служат Русселевские тельца – округлые включения, обнаруживаемые в старых плазмоцитах. Русселевские тельца называют надгробными памятниками плазматическим клеткам. Липопротеиды, входящие в состав мембран ЭР, по мнению большинства ученых, аналогичны тем, что входят в состав наружной клеточной мембраны. Обе мембраны могут соединяться и тогда ЭР открывается наружу клетки, в частности, это происходит в феноменах клеточной секреции. С другой стороны, удается рассмотреть тот момент, когда субстанции, проникающие в клетку, появляются в ЭР, при этом они, как правило, направляются к лизосомам. Следовательно, ЭР оберегает клетку от вторжения в нее инородных субстанций. Описанное под названием "дегрануляция шероховатого ЭР" уменьшение числа рибосом, связанных с ЭР, и общего числа рибосом часто наблюдается в гепатоцитах при интоксикации этионином, четыреххлористым углеродом и пиромицином. Эти изменения обратимы и свидетельствуют о снижении белкового синтеза. Наконец, необходимо помнить, что ЭР также является пристанищем для некоторых вирусов, в частности ретровирусов. В условиях патологии можно наблюдать два вида морфологических изменений – гиперплазию и атрофию эндоплазматического ретикулума.
Гиперплазия ЭР (гладкого или шероховатого), т.е. увеличение его количества может сопровождаться образованием концентрических структур, которые в световом микроскопе часто видны как участки эозинофильной цитоплазмы. Биохимически доказано, что в структурах, сформированных ГЭР, увеличивается число энзимов, ответственных за детоксикацию, таким образом, это явление свидетельствует об участии гладкого ЭР в процессах детоксикации. Подобные изменения неспецифичны и наблюдаются при воздействии афлотоксина, тетрахлористого углерода, ДДТ, диметилнитрозамина, фосфора, прогестерона, при вирусных инфекциях или опухолях (гепатома).
Атрофия ЭР, т.е. уменьшение его размеров сопровождается снижением белково-синтетической функции клетки (при голодании, болезнях печени, старении).
АППАРАТ ГОЛЬДЖИ (пластинчатый комплекс).
Структуры Гольджи образованы сплющенными мешочками (вакуолями), содержащими секреторные гранулы и анастамозами, которые взаимосвязаны с эндоплазматическим ретикулумом. В них протеины, предназначенные для секреции, конъюгируются с углеводными группами. Величина аппарата Гольджи связана с синтетической активностью клетки и обусловлена либо уровнем наружной секреции, например, в печени или поджелудочной железе, либо интенсивностью синтеза, необходимой для жизнедеятельности самой клетки, например, в нейронах.
Морфологические проявления нарушений секреторной функции выражаются или в виде гиперплазии пластинчатого комплекса, то есть увеличения площади его мембран и количества секреторных гранул, либо в виде атрофии пластинчатого комплекса, что сопровождается редукцией (уменьшением) вакуолей и потерей секреторных гранул. Гиперплазия аппарата Гольджи обычно сочетается с гиперплазией эндоплазматического ретикулума. Если синтез тех или иных веществ опережает их секрецию и выведение, то эти вещества накапливаются в аппарате Гольджи и могут его повреждать. Например, накопление желчи в гепатоцитах при холестазе. Атрофия аппарата Гольджи свидетельствует о снижении его функциональной активности. Одной из причин такого снижения может быть белковое голодание, а также нарушение взаимодействия пластинчатого комплекса с эндоплазматической сетью.
ЛИЗОСОМЫ
Лизосомы встречаются в клетках в норме и патологии. Они участвуют в питании клетки, разрушении клеток или их стареющих частей, тем самым облегчая восстановление клеток или способствуя их нормальному созреванию. Лизосомы обеспечивают сохранность биологического равновесия, нарушенного агрессивными агентами при многочисленных процессах – воспалении, иммунной защите, нарушении коагуляции крови и др.
Лизосомы можно определить как электронно-плотные структуры небольших размеров, которые имеют вид полиморфных гранул или везикул, окруженных липопротеидной мембраной (рис. 5). Это определение относится, главным образом, к первичным лизосомам, которые являются дериватами (производными) эндоплазматического ретикулума и аппарата Гольджи. Они способны разрушать протеины, липиды, полисахариды и нуклеиновые кислоты при помощи более 50 лизосомальных ферментов типа гидролаз.
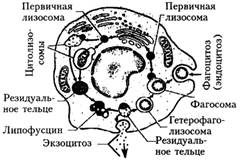
Рис.5. Схема формирования первичных и вторичных лизосом
Первичные лизосомы объединяются с другими вакуолями, выбрасывая свое содержимое в них, и образуют таким образом вторичные лизосомы: пинолизосомы, фаголизосомы и аутофаголизосомы или цитолизосомы (цитолизомы). Они довольно полиморфны и богаты кислой фосфатазой. Если процесс переваривания полностью не осуществляется, в них образуются резидуальные (остаточные) тельца или телолизосомы, имеющие самый разнообразный вид. Одни из них удаляются из клетки путем экзоцитоза, другие – путем клазматоза. Некоторые телолизосомы подвергаются биохимической переработке и удаляются путем диффузии через клеточную мембрану. Другие могут образовывать коричневатые комплексы, такие как липофусцин, липосидерин, гемосидерин и др., которые остаются внутриклеточно или удаляются из клетки. Гранулы липофусцина рассматриваются некоторыми авторами как продукты распада липопротеидов мембран и носят название "пигмент изнашивания клетки". Их называют также третичными лизосомами.
Таким образом, лизосомы относятся к внутриклеточной литической, или "переваривающей" системе. В некоторых клетках переваривающая функция может быть доминирующей, как например, в полиморфно-ядерных лейкоцитах. В отличие от большинства органелл, ранее изученных, лизосомы обладают катаболической, а не анаболической функцией. Эту функцию лизосомы осуществляют при помощи двух механизмов – путем эндоцитоза и аутофагии.
Эндоцитоз. Этот процесс очень часто наблюдается в проксимальных извитых канальцах почек. Протеины, особенно с низким молекулярным весом, после прохождения гломерулярного фильтра реабсорбируются и накапливаются лизосомами клеток эпителия извитых канальцев почек. По-видимому, именно это явление Вирхов описал под названием "мутное набухание". Наличие в клетках канальцев почек при многих протеинуриях гранул с положительной реакцией на кислую фосфатазу свидетельствует об их лизосомальном происхождении.
Аналогичное накопление протеинов, осуществляемое лизосомами, может наблюдаться в печени (клетках Купфера, мононуклеарных фагоцитах).
Аутофагия. Способность лизосом захватывать и разрушать собственные структуры клетки объясняет, каким образом большие молекулы, такие как гликоген и ферритин, могут проникать в эти органеллы. Механизм аутофагии начинается с образования вокруг участка цитоплазмы системы гладких мембран, которые охватывают циркулярно этот участок и сливаются в форме вакуоли, в которую первичные лизосомы выбрасывают свои энзимы. Этот феномен, описываемый под названием "фокальный клеточный некроз", играет роль внутреннего регулятора цитоплазмы. Можно предположить, что он позволяет клетке контролировать число ее митохондрий, репродукция которых осуществляется более или менее автономно.
ЛИЗОСОМАЛЬНЫЕ БОЛЕЗНИ
Повреждение лизосомальных мембран. Дестабилизация (лабилизация) лизосомальных мембран в виде трещин и разрывов может наблюдаться при воздействии различных агрессивных факторов: ионизирующей радиации, аноксии, шоке, отравлении тетрахлористым углеродом, воздействии кремния, недостатке витаминов и гипервитаминозе А, воздействии бактериальных эндотоксинов и т.д. В этих случаях гидролазы диффундируют в клетку, что ведет к ее некрозу или прогрессивному разрушению путем самопереваривания.
Однако, имеется большое число стабилизаторов лизосомальной мембраны, защищающих ее от внешних воздействий. К ним относятся холестерол, кортикоиды, витамин Е в малых дозах, антигистамин и т. д. Они повышают резистентность клеток по отношению к агрессору. Лизосомы продуцируют также большое число инактиваторов агрессивных агентов, например, при воспалении, иммунных реакциях, интоксикации. Когда эта функция избыточна и превышает силу агрессии или блокирует ее природу, лизосомы не принимают больше участия в гомеостазе. Они становятся анормальными и растянутыми.
Недостаток лизосомальных энзимов. В лизосомах могут отсутствовать некоторые энзимы, необходимые для нормального метаболизма клеток. Энзимопатия или дисметаболическая болезнь имеет врожденный характер и передается по наследству по аутосомно-рецессивному типу. Дефицит энзимов наблюдается наиболее часто при гликогенозах (болезнь Помпе, болезнь Гирке), липидозах (недостаточность липаз адипозоцитов), гепатозах (болезнь Дабина-Джонсона). Эти состояния иногда называют "болезнями накопления". В реальной действительности речь идет не об избыточном образовании различных субстанций, а о замедлении или остановке разрушения их метаболитов при нормальном синтезе. Выражение "лизосомальные болезни" отражает генетический дефицит лизосомальных ферментов, а не собственно повреждение лизосом. Только некоторые состояния могут несомненно соответствовать этому термину. Это редкая болезнь Шедиака-Хигачи, при которой выявляются крупные гранулы в поврежденных лизосомах полинуклеаров крови. Аналогичное состояние наблюдается также у алеутских норок и касается нарушения синтеза различных клеточных включений, в частности, зерен меланина, что сопровождается их избыточным накоплением в лизосомах и нарушением функции. Синдром включает: альбинизм, нейтропению, аденопатию, гепатоспленомегалию, рецидивирующие инфекции. Феномен накопления в лизосомах лежит в основе болезни Вильсона, при которой накапливается медь и гемохроматоза, сопровождающегося накоплением ферритина.
ПЕРОКСИСОМЫ (микротельца)
Пероксисомы представляют собой гранулы, содержащие множество энзимов, таких как Д-аминоацид-оксидаза, каталаза и уриказа (отсюда название – урикосомы). Эти органеллы выявляются среди ЭР.
Увеличение их числа в гепатоцитах описано при применении медикаментов, снижающих уровень липемии, вирусном гепатите, лептоспирозе, в кардиомиоцитах при длительном воздействии этанола. Изменение структуры урикосом было описано при болезнях Menkes и Wilson.
Уменьшение числа пероксисом и снижение синтеза их ферментов наблюдается в печени при воспалении, а также при опухолевом росте. Разрушение пероксисом отмечается при гиперлипидемии и гиперхолестеринемии.
ПЕРОКСИСОМНЫЕ БОЛЕЗНИ
В настоящее время известны три синдрома, которые рассматривают как наследственные пероксисомные болезни: акаталаземия, цереброгепаторенальный синдром Целлвегера и системная недостаточность карнитина.
Акаталаземия – заболевание, в основе которого лежит резкое снижение активности каталазы в печени и других органах. Основным клиническим синдромом этого заболевания являются гангренозные изъязвления полости рта.
Цереброгепаторенальный синдром Целлвегера характеризуется:
1. отсутствием пероксисом в гепатоцитах;
2. снижением каталазной активности печени до 20% и менее;
3. редукцией эндоплазматического ретикулума;
4. атрофией и уменьшением числа митохондрий;
5. увеличением в гепатоцитах количества гранул гликогена и липидных вакуолей.
Ведущим клиническим проявлением недостаточности пероксисом является нарушение синтеза желчных кислот. Системная недостаточность карнитина сопровождается окислением жирных кислот в скелетных мышцах, печени, плазме крови. В клинике наблюдается миопатия с периодическими нарушениями функции печени и головного мозга.
ЦИТОЗОЛЬ (ЦИТОПЛАЗМАТИЧЕСКИЙ МАТРИКС)
Цитозоль – это компонент цитоплазмы, структурно не относящийся к органеллам и содержащий белки, из которых происходит сборка органелл, растворимых ферментов, участвующих в промежуточном обмене клетки. Его вязкость варьирует, возрастая с увеличением количества содержащихся в нем филаментов.
Вариации плотности цитозоля
Увеличение плотности цитозоля. Это неспецифический ответ на различные типы повреждающих факторов: аноксию или гипоксию, интоксикацию, действие вируса, раковую интоксикацию, ионизирующую радиацию, воздействие высокой температуры, электрический ток и т.д. Цитоплазма становится ацидофильной в световом микроскопе и более плотной при обычном электронно-микроскопическом изучении в результате уменьшения содержания в ней воды или денатурации белков. Альтерация сопровождается в некоторых случаях дилятацией шероховатого ЭР или уплотнением митохондриального матрикса и нуклеоплазмы. Она не всегда обратима. При коагуляционном некрозе в электронном микроскопе видны плотные и аморфные обрывки гиалоплазмы, а в световом микроскопе цитоплазма однообразно ацидофильна.
Уменьшение плотности цитозоля может быть связано с уменьшением или прекращением белкового синтеза, а также с проникновением в цитоплазму воды. При локальном уменьшении плотности говорят о хромолизе.
ПАТОЛОГИЯ НЕМЕМБРАННЫХ ОРГАНЕЛЛ
РИБОСОМЫ
Рибосомы, как свободные, так и связанные с мембранами эндоплазматического ретикулума, являются необходимыми органоидами для распознавания генетического кода клетки. Локализация рибосом связана с типом синтезируемых белков. Свободные рибосомы, находящиеся в базофильных эритробластах и в нейронах, обеспечивают синтез клеточных белков. Напротив, рибосомы, ассоциированные с мембранами ЭР, выявляются во всех секретирующих клетках.
В условиях патологии рибосомы могут строить хорошо очерченные геометрические фигуры. Например, при воздействии афлотоксина и в опухолевых клетках лимфомы Беркитта они имеют вид спирали. Аналогичные изменения наблюдаются в клетках при гипотермии, при кислородном голодании и дефиците белка в организме.
ПАТОЛОГИЯ МИКРОТРУБОЧЕК И МИКРОФИЛАМЕНТОВ
Микротрубочки (макрофиламенты) занимают особое место в межклеточных сообщениях. Большинство клеток содержат комплексы фибриллярных структур, которые выполняют опорную, транспортную, сократительную и двигательную функции. Специализированные клетки могут также содержать аналогичные фибриллы, но они отличаются биомеханически.
Для некоторых органелл характерно соединение микротрубочек в группы, обычно числом девять, например, триплеты в центриолях, дуплеты в ресничках. Микротрубочки являются очень сложными структурами и содержат много протеинов, а также АТФ-азу, которая участвует в построении мерцательного эпителия.
Существуют генетические аномалии числа или расположения дуплетов. Например врожденный синдром неподвижных ресничек (синдром Картагенера) характеризуется тем, что реснички покровного эпителия дыхательных путей и слизистой оболочки среднего уха неподвижны или малоподвижны. Поэтому мукоцилиарный транспорт резко ослаблен или отсутствует, что ведет к хроническому воспалению дыхательных путей и среднего уха. У таких больных неподвижны также сперматозоиды, так как их хвост эквивалентен ресничкам.
Отсутствие связи между периферическими и центральными дуплетами в ресничках сопровождается их неподвижностью. Это может наблюдаться при самой разнообразной патологии:
1. при инфекционных бронхитах, сопровождающихся иммобилизацией ресничек и отсутствием их движений в слизистой бронха;
2. у курильщиков очень часто отмечается неподвижность патологически измененных ресничек, в которых содержится множество дуплетов (рис.6);
3. размножение центриолей с образованием "кист ресничек" часто наблюдается в генитальном тракте женщин при хронических воспалительных заболеваниях (гонорея, хламидиоз, уреаплазмоз и др.)
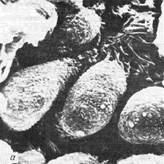
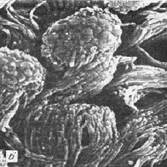
Рис.6. Ультраструктура слизистой оболочки носа. Сканирующая электронная микроскопия.
а – редукция ресничек мерцательного эпителия при пылевом бронхите;
б – неизмененный реснитчатый эпителий.
Различные вещества, например, колхицин, алкалоиды барвинка (винбластин, винкристин), сульфгидрильные реактивные группы (кокадилат, диамид) могут разрушать микротрубочки. Все эти вещества влияют на митоз, изменяют функции клеток, связанные с микротрубочками.
Микрофиламенты. Актиновые филаменты и миозин обнаружены почти во всех клетках, независимо от того, являются ли они мышечными или немышечными.
Патология микрофиламентов разнообразна по этиологии и патогенезу. Резкое увеличение микрофиламентов находят в эпителии желчных протоков при первичном билиарном циррозе печени. Известно, что циркуляция желчи в печени регулируется микрофиламентозной системой. Однако вопрос о том, первична или вторична аккумуляция микрофиламентов в эпителии билиарной системы, еще не решен. Увеличение количества микрофиламентов описано в клетках при заживлении ран, а также в опухолях, особенно в зонах инвазии.
Промежуточные филаменты достаточно специализированы в зависимости от типа клеток. Однако, в клетках одного и того же происхождения могут встречаться промежуточные филаменты разного типа. К промежуточным филаментам относятся: цитокератины – в эпителиальных клетках, десмин – в мышечных клетках, виментин – в мезенхимальных клетках, нейрофиламенты – в клетках центральной и периферической нервной системы, глиальные филаменты – в клетках глии.
Патология промежуточных филаментов связана с их накоплением в клетке и наблюдается при образовании алкогольного гиалина (телец Мэллори), болезни Альцгеймера и некоторых формах кардиомиопатий.
1. Гиалин Мэллори (алкогольный гиалин). Известный американский патолог Мэллори в начале века описал в клетках печени при алкоголизме гиалиновые включения неправильной формы, которые носят его имя. Длительное время дискутировался вопрос об их специфичности. Гиалин Мэллори может появляться во многих случаях, но чаще всего при алкогольном циррозе. Экспериментально он был вызван у животных с помощью гризеофульвина (его используют в клинике как антигрибковое средство). В настоящее время накопление промежуточных филаментов является морфологическим маркером хронического алкоголизма.
2. Болезнь Альцгеймера или “пресенильная” деменция сопровождается образованием фибриллярных масс в нейронах коры головного мозга у пожилых людей. Эти фибриллярные массы окрашиваются как амилоидные субстанции конго-красным и дают двойное лучепреломление в поляризованном свете. Но они всегда выявляются внутриклеточно, в отличие от амилоида, который всегда расположен экстрацеллюлярно. В клинике у таких больных развивается слабоумие.
3. Кардиомиопатии, связанные с нарушением метаболизма десмина, клинически проявляются прогрессирующей недостаточностью миокарда и характеризуются массивными отложениями в кардиомиоцитах ШИК-негативного материала, состоящего из промежуточных филаментов.
ЦИТОПЛАЗМАТИЧЕСКИЕ ВКЛЮЧЕНИЯ
Секреторные гранулы. Они представлены в клетках тремя разновидностями – это гранулы экзо-, эндо- или нейросекретов. Важное место в патологии занимает секреция аномальных (больших по объему) секреторных гранул при синдроме Шедиак-Хигачи.
Меланин и меланосомы. Меланин секретируется меланоцитами кожи, специфической функцией которых является синтез меланинового пигмента и образование меланосом. Оба этих процесса независимы, поскольку меланоциты могут содержат меланосомы без меланина. Такие меланоциты встречаются у альбиносов и при локальной депигментации кожи. При ультрафиолетовом облучении в базальных кератиноцитах происходит накопление меланосом над апикальной частью ядра, что формирует своеобразный экран, защищающий генетический аппарат клетки от повреждающего излучения. При альбинизме невозможен синтез меланина вследствие недостаточной полимеризации дериватов ароматических кислых аминов.
Белковые гранулы описаны двух типов. Примером первого типа могут служить белковые гранулы, обычно ацидофильные в световом микроскопе, ШИК-положительные (гликопротеины), наличие которых обусловлено дефицитом α1-антитрипсина. Они могут встречаться в клетках печени, почек, в нейронах, в доброкачественных или злокачественных опухолях. α1-антитрипсин образуется в печени и ингибирует коллагеназу, а в большинстве тканей – эластазу. При дефиците α1-антитрипсина эластаза повреждает легочную ткань, что приводит к развитию эмфиземы.
Примером второго типа служат ацидофильные белковые гранулы, или тельца Леви, наблюдаемые в симпатических нейронах. Они представляют собой удлиненной формы эозинофильные и ШИК-негативные образования и являются типичными для идиопатической болезни Паркинсона.
Тубулоретикулярные включения располагаются в эндоплазматическом ретикулуме и образуют ячейки из анастомозирующих между собой неправильных трубочек. Они впервые были обнаружены в гломерулярных капиллярах почек при аутоиммунном заболевании – диссеминированной красной волчанке. Эти включения имеют сходство с некоторыми вирусными включениями, например, с миксовирусами. Имеется гипотеза, что тубулоретикулярные включения имеют вирусное происхождение. Они выявляются в коже, в почках, в лимфоцитах при различных повреждениях – склеродермии, идиопатической пурпуре, синдроме Гудпасчера, при злокачественных лимфомах. Их можно воспроизвести экспериментально при помощи 5-бром-деоксиуридина в культуре лимфоцитов. Этот препарат используется в антивирусной терапии и может демаскировать латентный вирус.
ЯДРО
Сублетальные альтерации, обратимые
Конденсация и маргинация хроматина – накопление хроматина под мембраной ядра в виде регулярной ленты или маленьких комочков. При этом ядро несколько уменьшено в объеме. Конгломерат хроматина появляется в результате снижения pH клеток при усиленном гликолизе. Этот процесс представляет собой непосредственный ответ на разнообразную агрессию и, несомненно, первое его проявление.
Изменение ядерной мембраны. Вакуоли и псевдовакуоли. Известно, что ядерная мембрана состоит из двух липопротеидных листочков (пластинок), в которых имеются поры или округлые отверстия. Внутренняя пластинка гладкая, наружная покрыта рибосомами и находится в контакте с эндоплазматическим ретикулумом.
В условиях патологии в ядрах могут появляться истинные вакуоли и псевдовакуоли.
При воздействии ряда болезнетворных факторов эта мембрана может становится прерывистой, например, при дилятации перинуклеарных цистерн, либо образовывать локальные пузырьки путем инвагинации внутреннего листка ядерной мембраны, например, в ответ на действие радиации. Это и есть истинные внутриядерные вакуоли.
Псевдовакуоли формируются путем внутриядерной инвагинации цитоплазмы, окружены двумя пластинками мембраны и содержат различные частицы, органеллы, в частности рибосомы. Они характерны для некоторых типов клеток, таких как менингеальные, шванновские, невусные и т.д., а также выявляются в опухолевых клетках. Псевдовакуоли обнаруживаются в гепатоцитах при различных метаболических нарушениях.
Внутриядерные включения. Различают истинные включения и псевдовключения.
Истинные включения представлены некоторыми вирусами. Псевдовключения представляют собой частицы гликогена (в ядрах гепатоцитов при сахарном диабете), а также сферические, линейные, фибриллярные структуры, природа которых не всегда известна. В глиальных клетках фибриллярные структуры выявляются после воздействия гидрооксида алюминия Al(OH)3. Появление сферических тел связано с повышенным синтезом протеинов и накоплением фибриллярных структур. Сложные структуры появляются в гепатоцитах и эпителиальных клетках канальцев почек после воздействия тяжелых металлов (Pb и Vi).
Летальные повреждения, необратимые
Различают три типа необратимых морфологических изменений ядра: пикноз, кариорексис и кариолизис.
Пикноз. Неблагоприятным исходом обратимой конденсации и маргинация хроматина под ядерной оболочкой может быть необратимая тотальная его конденсация по всей площади ядра. Тогда ядро становится гомогенным, интенсивно базофильно окрашенным и сморщенным – это и есть пикноз. Очевидно, что когда ядро пикнотично – оно мертвое. Нити хроматина конденсируются в результате действия ДНК-азы и лизосомальных катепсинов и их деструкция наступает более или менее быстро.
Кариорексис (rexis – разрыв). Это раскалывание конденсированного хроматина, обычно на небольшие по объему, неправильной формы фрагменты, которые могут находится внутри ядерной мембраны, если она сохранена или располагаться в цитоплазме при ее деструкции.
Кариолизис (lysis – растворение, расплавление) – это вид смерти ядра, при котором хроматин более или менее тотально дезинтегрирован и не окрашивается. Создается впечатление, что ядро лишено хроматина, исчезающего вследствие абсорбции окружающей цитоплазмой.
Считают, что кариопикноз, кариорексис и кариолизис существуют как последовательные стадии смерти ядра. В действительности, очень часто, но не постоянно, кариорексис может наблюдаться без пикноза и кариолизис может не наступить, если клетка умрет тотчас после пикноза или кариорексиса, а фрагменты хроматина при этом элиминируются наружу.
Альтерация митоза
Аномалии митотического ритма. Митотический ритм, обычно адекватный потребности восстановления стареющих, десквамированных, погибших клеток, в условиях патологии может быть изменен. Замедление ритма наблюдается в стареющих или маловаскуляризированных тканях, увеличение ритма – в тканях при разных видах воспаления, гормональных воздействиях, в опухолях и др.
Аномалии развития митозов. Некоторые агрессивные агенты, действуя на фазу S, замедляют синтез и дупликацию ДНК. К ним относятся ионизирующая радиация, различные антиметаболиты (метатрексат, меркапто-6-пурин, флюоро-5-урацил, прокарбозин и др.). Их используют для противоопухолевой химиотерапии. Другие агрессивные агенты действуют на фазу М и препятствуют образованию ахроматического веретена. Они изменяют вязкость плазмы, не расщепляя нити хромосом. Такое цитофизиологическое изменение может повлечь за собой блокаду митоза в метафазу, а затем – острую смерть клетки, или митонекроз. Митонекрозы часто наблюдаются, в частности, в опухолевой ткани, в очагах некоторых воспалений с некрозом. Их можно вызвать при помощи подофиллина, который применяется при лечении злокачественных новообразований.
Аномалии морфологии митозов. При воспалении, действии ионизирующей радиации, химических агентов и особенно в злокачественных опухолях обнаруживаются морфологические аномалии митозов. Они связаны с тяжелыми метаболическими изменениями клеток и могут быть обозначены как “абортивные митозы”. Примером такой аномалии служит митоз с анормальным числом и формой хромосом; трех-, четырех- и мультиполярные митозы.
Многоядерные клетки. Клетки, содержащие множество ядер, встречаются и в нормальном состоянии, например: остеокласты, мегакариоциты, синцитиотрофобласты. Но они встречаются часто и в условиях патологии, например: клетки Ланхганса при туберкулезе, гигантские клетки инородных тел, множество опухолевых клеток. Цитоплазма таких клеток содержит гранулы или вакуоли, число ядер может колебаться от нескольких единиц до нескольких сотен, а объем отражен в названии – гигантские клетки. Происхождение их вариабельно: эпителиальные, мезенхимальные, гистиоцитарные. Механизм формирования гигантских многоядерных клеток различен. В одних случаях их образование обусловлено слиянием мононуклеарных клеток, в других оно осуществляется благодаря делению ядер без деления цитоплазмы. Считают также, что их образование может быть следствием некоторых аномалий митоза после облучения или введения цитостатиков, а также при злокачественном росте.
ИЗМЕНЕНИЯ ЯДРЫШЕК
В нормальных условиях размеры и структура ядрышек в большинстве случаев адекватны интенсивности клеточного белкового синтеза. В условиях патологии (например, в опухолевых клетках) высокая функциональная (секреторная) активность клетки часто сопровождается увеличением объема, а иногда и количества ядрышек с их вакуолизацией. В этих случаях говорят о ядрышковой гидропии (или гидропическом ядрышке).
Дезинтеграция (сепарация) ядрышковых структур на гранулы и фибриллы РНК отражает нарушение функционального состояния как ядрышек, так и клетки, и встречается при действии различных агентов, таких как актиномицин, афлатоксин, ионизирующая радиация и сопровождается изменением синтеза РНК.
ЛЕКЦИЯ № 2
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 3238; Нарушение авторских прав?; Мы поможем в написании вашей работы!