
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Воспаление. Лабильные клетки (митотически активные клетки)
|
|
|
|
Лабильные клетки (митотически активные клетки). Примеры лабильных клеток: базальные эпителиальные камбиальные клетки всех типов эпителия и гемопоэтические стволовые клетки в костном мозге.
Лабильные клетки обычно делятся активно в течение всей жизни, являясь источником для восстановления клеток, которые непрерывно погибают. Лабильные клетки имеют короткий G0 период (период отдыха или межмитотический период). Непрерывная потеря зрелых клеток данной ткани – непрерывный стимул для вхождения неактивных клеток в митотический цикл. Зрелые дифференцированные клетки в этих специфических тканях не могут делиться; их количество поддерживается делением их стволовых лабильных клеток.
Повреждение ткани, содержащей лабильные паренхиматозные клетки, сопровождается быстрой регенерацией. Например, хирургическое удаление эндометрия при кюретаже или физиологическая потеря эндометрия в течение менструации сопровождается полной регенерацией клеток от базального герминативного слоя в течение нескольких дней. Разрушение эритроцитов в периферической крови (гемолиз) стимулирует гиперплазию клеток-предшественников гемопоэза в костном мозге, что в результате приводит к регенерации разрушенных красных клеток крови. Регенерация в тканях с лабильными клетками происходит только тогда, когда после повреждения остается достаточное количество лабильных клеток. В примере, приведенном выше, чрезмерно усердный хирургический кюретаж эндометрия, при котором удаляется весь эндометриальный слой, включая базальный, приводит к невозможности регенерации. Заживление тогда происходит путем формирования рубца, что ведет к нарушениям менструального цикла и бесплодию. Еще пример: радиоактивное излучение или высокие дозы некоторых лекарств, могут уничтожить все клетки-предшественники гемопоэза в костном мозге и тогда регенерация невозможна, и это приводит к развитию апластической анемии.
Относительно стабильные клетки (обратимо постмитотические или “покоящиеся” клетки) – примерами относительно стабильных клеток являются паренхиматозные клетки наиболее важных железистых органов (печень, поджелудочная железа) и мезенхимальные клетки (фибробласты, эндотелиальные клетки). Относительно стабильные клетки обычно имеют длительный срок существования и поэтому характеризуются низкой митотической активностью. Они остаются в фазе G0 в течение длительного времени (часто годами), но сохраняют способность к делению, входя в митотический цикл по мере возникновения потребности. В отличие от лабильных клеток, которые являются недифференцированными клетками и делятся часто, а созревают и становятся функционирующими их дочерние клетки, относительно стабильные клетки дифференцированы и являются функционирующими клетками, которые возвращаются к делению только при необходимости. Хотя относительно стабильные клетки имеют длительную стадию отдыха, они могут быстро делиться при возникновении потребности, например, паренхиматозные клетки печени быстро восстанавливаются после некроза гепатоцитов.
Регенерация в тканях, образованных из относительно стабильных клеток, требует наличия достаточного количества жизнеспособной ткани для обеспечения регенерации паренхиматозных клеток, а также требует сохранности соединительнотканной основы ткани. Повреждения почек иллюстрируют потребность в сохранной соединительнотканной основе. При избирательном некрозе клеток канальцев почки (острая почечная недостаточность) с сохранением соединительнотканной основы почечных канальцев регенерация происходит быстро, и потерянные клетки заменяются путем деления выживших клеток канальцев. С другой стороны, когда происходит некроз и паренхимы, и соединительной основы ткани (инфаркт почки), регенерация невозможна и заживление происходит путем формирования рубца.
Постоянные клетки (необратимо постмитотические клетки). Примерами постоянных клеток являются нейроны в центральной и периферической нервной системе и клетки миокарда. Постоянные клетки не имеют никакой способности митотического деления в постнатальной жизни.
Повреждение постоянных клеток всегда сопровождается формированием рубца. Полная регенерация невозможна. Потеря постоянных клеток поэтому необратима и, если некроз обширный, это может приводить к нарушению функции органов.
РЕГЕНЕРАЦИЯ КРОВЕНОСНЫХ СОСУДОВ
Регенерация кровеносных сосудов протекает неоднозначно в зависимости от калибра. Регенерация сосудов микроциркуляторного русла – капилляров, венул, артериол – может происходить путем почкования или аутогенно.
При регенерации сосудов путем почкования в их стенке появляются боковые выпячивания за счет усиленно делящихся эндотелиальных клеток (ангиобласты, эндотелиобласты). Образуется эндотелиальный вырост, который превращается в тяж без просвета. Затем под давлением крови из “материнского” сосуда образуется капилляр. Другие элементы сосудистой стенки образуются за счет дифференцировки камбиальных клеток окружающей соединительной ткани.
Аутогенное новообразование сосудов состоит в том, что в соединительной ткани появляются очаги недифференцированных клеток. В этих очагах возникают щели, в которые открываются предсуществующие капилляры и изливается кровь. Молодые клетки соединительной ткани, дифференцируясь, образуют эндотелиальную выстилку и другие элементы стенки сосуда. Такой путь новообразования капилляров наблюдается в период эмбриогенеза и в опухолях.
Крупные сосуды не обладают достаточными пластическими свойствами. Поэтому при повреждении их стенки восстанавливаются лишь структуры внутренней оболочки, ее эндотелиальная выстилка. Элементы средней и наружной оболочек восстанавливаются за счет рубцевания.
РЕГЕНЕРАЦИЯ СОЕДИНИТЕЛЬНОЙ ТКАНИ
Процесс заживления дефекта ткани путем формирования рубца делится на несколько стадий.
Подготовка. На начальном этапе регенерации происходит удаление некротического детрита, то есть обломков всех погибших клеток, воспалительного экссудата, включая фибрин и кровь. Этот детрит разжижается лизосомными ферментами нейтрофилов, которые мигрируют в эту область. Разжиженный материал удаляется по лимфатической системе; любые остатки в виде частиц удаляются макрофагами путем фагоцитоза.
Разрастание грануляционной ткани знаменует конец первого этапа регенерации – фазы пролиферации клеток. Грануляционная ткань – высоко васкуляризированная соединительная ткань, составленная из заново сформированных капилляров и пролиферирующих камбиальных клеток соединительной ткани (малые и большие круглые, эпителиоидные клетки). Эти клетки мигрируют по ходу капилляров в поврежденную область. Формирующаяся грануляционная ткань заполняет поврежденную область по мере того, как некротический детрит удаляется. Пролиферация капилляров, фибробластов и других клеток в процессе заживления регулируется разнообразными факторами роста и ингибирующими факторами.
Макроскопически грануляционная ткань мягкая и пестрая (кажется розовой и “гранулярной”) из-за наличия многочисленных капилляров.
Микроскопически обнаруживается множество тонкостенных (образованных эндотелием) капилляров, окруженных недифференцированными клетками соединительной ткани. Пролиферирующие камбильные клетки соединительной ткани являются метаболически высоко активными, с большими ядрами и видимыми ядрышками; иногда видны фигуры митоза. При электронной микроскопии выявляется расширенный шероховатый эндоплазматический ретикулум в цитоплазме фибробластов - индикатор активного синтеза белка.
Через какое-то время – продолжительность зависит от степени повреждения – вся область заживления заменяется разрастающейся грануляционной тканью.
Синтез фибронектина. Фибронектин – гликопротеин (MВ 44,000) играет ключевую роль в формировании грануляционной ткани и выявляется в большом количестве в процессе заживления раны. На ранних стадиях он поступает из плазмы, а позже синтезируется фибробластами, макрофагами и эндотелиальными клетками в грануляционной ткани. Фибронектин хемотаксичен для фибробластов и ускоряет формирование капиллярных сосудов из эндотелиальных клеток.
Созревание. При созревании грануляционной ткани содержание коллагена прогрессивно увеличивается со временем. Коллаген – главный фибриллярный белок соединительной ткани. Он синтезируется фибробластами в форме предшественника – тропоколлагена (проколлаген), который имеет молекулярный вес 285,000 и по форме напоминает длинные нити. Во время или вскоре после секреции заключительное ферментативное удаление терминальной части цепи пептидов ведет к формированию нерастворимой молекулы фибриллярного коллагена. При световой микроскопии коллаген выявляется как фибриллярная масса, которая окрашивается в розовый цвет при обычной окраске гематоксилином и эозином и в зеленый или синий цвет – при окраске трихромовыми красителями. Молодые фибробласты в грануляционной ткани синтезируют коллаген III типа, который позже заменяется на I тип коллагена, имеющий более плотные перекрестные связи между цепями.
Молодой рубец состоит из грануляционной ткани, умеренного количества коллагена, большого числа капилляров и фибробластов. Он кажется розовым при макроскопическом исследовании из-за васкуляризации. По мере созревания рубца количество коллагена увеличивается, а клеток и сосудов становится меньше. Зрелый рубец составлен из бессосудистого скопления коллагена, между волокнами которого редко сохраняются клетки, вследствие чего он имеет белый цвет при макроскопическом исследовании.
Ткань рубца не является неактивной; в ней происходит непрерывное медленное удаление коллагена ферментом коллагеназой, которое сбалансировано синтезом нового коллагена фибробластами. Даже старые рубцы могут разрыхляться при нарушении нормальной активности фибробластов, например, при дефиците витамина C или введении кортикостероидов.
Сокращение и уплотнение. Сокращение и уплотнение составляют конечную (заключительную) стадию заживления путем формирования рубца. При контракции уменьшается размер рубца, что позволяет остающимся в живых клеткам органа функционировать с максимальной эффективностью; например, преобразование большого миокардиального инфаркта в маленький рубец позволяет оптимально функционировать оставшемуся миокарду.
Сокращение начинается на ранних стадиях заживления и продолжается по мере созревания рубца. Раннее сокращение возникает благодаря активному сокращению филаментов актомиозина в некоторых специализированных миофибрилл-содержащих фибробластах (которые также называются миофибробластами). Более позднее сокращение – свойство непосредственно молекулы коллагена.
Предел прочности рубца зависит от количества коллагена и прогрессивно увеличивается, в конце первой недели он составляет приблизительно 10%, а через несколько месяцев – 80% от его окончательного предела прочности. Увеличение предела прочности возникает в результате увеличения количества коллагена, изменения типа коллагена (с III на I) и увеличения ковалентных связей между молекулами коллагена. Полностью сформированный рубец – гладкий, неэластичный, подвижной структуры.
РЕГЕНЕРАЦИЯ ЭПИТЕЛИЯ
Регенерация эпителия осуществляется, как правило, полно, поскольку он обладает высокой регенераторной способностью.
Особенно хорошо регенерирует покровный эпителий (многослойный плоский ороговевающий и неороговевающий, переходный, однослойный призматический и многорядный мерцательный). Например, восстановление многослойного плоского ороговевающего эпителия осуществляется за счет размножения клеток мальпигиевого слоя. Образующиеся эпителиальные клетки сначала покрывают дефект одним слоем. В дальнейшем пласт эпителия становится многослойным, клетки его дифференцируются и он приобретает все признаки эпидермиса, включающего в себя ростковый, зернистый, блестящий и роговой слои. При нарушении регенерации эпителия кожи образуются незаживающие язвы, нередко с разрастанием в их краях атипичного эпителия, что может служить основой для развития рака кожи.
Регенерация специализированного эпителия органов (печени, поджелудочной железы, почек, желез внутренней секреции) осуществляется по типу регенерационной гипертрофии: в участках повреждения ткань замещается рубцом, а по периферии его происходит гиперплазия и гипертрофия клеток паренхимы. В печени участок некроза всегда подвергается рубцеванию, однако в остальной части органа происходит интенсивное новообразование клеток, а также гиперплазия внутриклеточных структур, что сопровождается их гипертрофией. Регенераторные возможности печени очень высоки. В почках при некрозе эпителия канальцев происходит размножение сохранившихся нефроцитов и восстановление канальцев при условии сохранения базальной мембраны. При ее разрушении (тубулорексис) эпителий не восстанавливается и каналец замещается соединительной тканью. Не восстанавливается погибший каналец и в том случае, если одновременно погибает и сосудистый клубочек. В поджелудочной железе регенераторные процессы хорошо выражены как в экзокринных отделах, так и в панкреaтических островках. В железах внутренней секреции восстановительные процессы представлены неполной регенерацией.
ЗАЖИВЛЕНИЕ РАН КОЖИ
Понимание механизмов, вовлеченных в заживление ран кожи, обеспечивает понимание заживления вообще. Кожа состоит из эпидермиса, представленного многослойным плоским ороговевающим эпителием (базальный герминативный слой – это лабильные (камбиальные) клетки) и дермы, которая составлена из фибробластов, коллагена, кровеносных сосудов и придатков кожи (волосяные фолликулы, потовые железы, сальные железы). Клетки соединительной ткани дермы и придатков кожи относятся к относительно стабильным клеткам.
Типы повреждений кожи. Повреждения кожи классифицируются на основе тяжести и характера повреждения.
Ссадина: самая легкая форма повреждения кожи, характеризуется удалением поверхностной части эпидермиса. Так как основной базальный герминативный слой лабильных клеток неповрежден, эпителий восстанавливается полностью, без формирования рубца.
Разрез и разрыв: при резанной и рваной ране кожа повреждается на полную толщину (и эпидермис, и дерма), но с минимальной потерей герминативных клеток. Если края кожной раны тщательно сопоставляются, как, например, при хирургическом разрезе, восстановление происходит очень быстро. Простой разрез представляет собой идеальный вариант раны кожи в отношении процесса заживления, так как в ней не содержится чужеродный материал и она не инфицирована и поэтому заживает быстро и без осложнений.
Раны с дефектами эпидермиса: тяжелые повреждения (например, глубокие разрезы, разрывы, ожоги) характеризуются удалением больших областей эпидермиса, включая базальные герминативные клетки, с различной степени некрозом подлежащей дермы. В отличие от ссадины, отсутствие лабильных эпидермальных клеток на дне раны определяет необходимость эпидермальной регенерации из живых базальных герминативных клеток краев раны. Обширный некроз, который возникает в таких ранах сопровождается воспалением.
Заживление первичным натяжением:
Чистые резанные (например, операционные) и рваные раны, в которых края раны находятся на близком расстоянии друг от друга, заживают первичным натяжением. Маленький промежуток в эпидермисе и дерме заполняется свернувшейся кровью, которая формирует струп и как бы запечатывает кожу в течение 24 часов, предотвращая попадание инфекционных агентов в рану. Эпидермис восстанавливается быстро путем деления базальных клеток в краях раны. Эти клетки врастают под струп и восстанавливают непрерывность эпидермиса в пределах 48 часов. По мере созревания эпидермальных клеток поверхностные кератинизированные слои начинают отслаиваться, струп отделяется, обычно в конце первой недели.
В подлежащей дерме рана заполняется свернутой кровью и заживает путем формирования рубца. Небольшое количество свертков и тканевого детрита разжижается ферментами нейтрофилов и удаляется макрофагами путем фагоцитоза. Нейтрофилы появляются в ране в пределах 24 часов, быстро заканчивают процесс разжижения и, обычно, заменяются макрофагами к 3 дню. Рост фибробластов и новых сосудов (грануляционная ткани) в “подготовленной” дермальной полости начинается к 48 часам, а коллаген может обнаруживаться там в через 72 часа после повреждения. К 5 дню дермальный дефект заполняется грануляционной тканью и небольшим количеством рыхлой волокнистой соединительной ткани. Количество коллагена увеличивается в течение приблизительно 4-6 недель.
Молодой рубец, который становится видимым после отделения струпа, первоначально выглядит розовым из-за высокой васкуляризации дермальной грануляционной ткани. В течение следующих нескольких недель рубец становится белым в результате уменьшения числа кровеносных сосудов и увеличения количества коллагена в созревающем рубце. В конечном счете, рубец принимает нормальный цвет кожи в результате созревания эпидермиса.
Во время операции края хирургического разреза искусственно соединяются швами или скобами. При удалении швов в конце первой недели (при более позднем удалении их увеличивается риск инфицирования раны) предел прочности молодого рубца составляет приблизительно только 10% от прочности нормальной кожи. Прочность рубца увеличивается приблизительно до 30-50% от прочности нормальной кожи к 4 неделям и до 80% – после нескольких месяцев.
Заживление вторичным натяжением:
Раны, которые не в состоянии зажить первичным натяжением, заживают вторичным натяжением.
Причины невозможности заживления первичным натяжением – заживление первичным натяжением невозможно при следующих обстоятельствах:
- в рваных ранах, когда невозможно добиться сопоставления краев раны;
- когда в ране присутствует чужеродный материал;
- когда произошел обширный некроз тканей;
- когда рана инфицирована.
Если инфекция развивается после сопоставления краев раны, то в результате острого воспаления с нагноением происходит разрыв раны и гной прорывается наружу.
Течение вторичного натяжения. Процессы, обусловливающие заживление вторичным натяжением, аналогичны процессам, происходящим при заживлении первичным натяжением, но длятся они дольше из-за обширного повреждения тканей. Инфекционный агент удаляется при помощи острого воспаления. Жидкий экссудат и некротическая ткань удаляются путем ферментного разжижения, удаления по лимфатическим путям и фагоцитоза. Хирургическое удаление мертвой ткани и чужеродного материала из раны значительно ускоряют процесс очищения раны. Грануляционная ткань затем растет со стороны здоровой ткани на дне раны и перемещает некротизированную ткань к поверхности кожи.
Эпидермис восстанавливается из базальных клеток в краях раны. В больших ранах реэпителизация может протекать в течение нескольких недель. В этих ситуациях хирургическая трансплантация кожи может ускорить заживление.
После завершения эпителизации поверхности раны происходит коллагенизация грануляционной ткани. Конечный размер зрелого рубца меньше размеров первоначальной раны из-за сокращения рубца.
Придатки кожи (волосяные фолликулы и железы) восстанавливаются при наличии достаточного количества оставшихся в живых клеток. При обширных ранах кожи с полным разрушением кожных придатков образующийся кожный рубец обычно лишен этих структур.
Факторы, нарушающие процесс регенерации
На развитие регенераторного процесса влияют как общие, так и местные факторы (табл. 1). Хирурги должны учитывать неблагоприятные факторы, которые вредят заживлению, так как они увеличивают риск хирургических операций.
Таблица 1
Факторы, нарушающие процесс регенерации
| Местные | Общие |
| Инфекция Ишемия Нарушение иннервации Наличие инородных материалов Наличие некротизованных тканей Подвижность поврежденной ткани Избыточное натяжение поврежденной ткани Облучение ткани проникающей радиацией | Пожилой возраст Белковое голодание Дефицит витамина С Недостаточность поступления цинка Введение кортикостероидов Цитостатические (противоопухолевые) препараты Сахарный диабет Снижение количества нейтрофилов или макрофагов в крови Тяжелая анемия Повышенная кровоточивость Синдром Элерса-Данлоса |
1. Нарушение синтеза коллагена – одна из наиболее частых причин нарушения заживления раны и может наблюдаться при недостатке витамина C, белков, цинка. Предоперационная коррекция нарушенного баланса повышает возможность нормального заживления.
2. Чрезмерный синтез коллагена при заживлении раны приводит к формированию неправильных узловатых масс коллагена (келоид) в участках повреждения кожи. Келоиды часто возникают при заживлении незначительных ран кожи. При микроскопическом исследовании массы коллагена определяются в виде толстых, гиалинизированных полос. Формирование келоида наиболее часто наблюдается у чернокожих людей и при этом имеется семейная предрасположенность, но без определенного типа наследования. Причина не известна. Удаление келоида по косметическим причинам сопровождается формированием нового келоида.
3. Местные факторы – наиболее важными местными факторами, которые вызывают дефектное заживление ран, являются:
o Наличие чужеродных частиц, некротической ткани или чрезмерных количеств крови в ране нарушает процесс заживления. Чужеродный материал и некротическая ткань должны быть удалены хирургически, а перед наложением швов должен быть проведен тщательный гемостаз.
o Инфекция в ране приводит к развитию острого воспаления, обычно формированию абсцесса, что сопровождается увеличением раны и задержкой ее заживления.
o Нарушение кровотока – ишемия в результате сниженного притока крови или нарушение венозного оттока препятствует заживлению раны.
o Уменьшение жизнеспособности клеток – облучение ткани или введение антимитотических лекарств при химиотерапии опухолей приводят к недостаточному заживлению раны. Эти факты имеют важное значение для лечения больных со злокачественными опухолями, так как выбор времени проведения операции относительно радио- или цитостатической терапии должен быть отрегулирован для минимизации риска нарушения заживления.
4. Сахарный диабет – при сахарном диабете заживление раны нарушается, вероятно, вследствие недостаточной микрогемоциркуляции и возникновения благоприятных условий для развития инфекции.
5. Чрезмерный уровень кортикостероидов – повышение уровня кортикостероидов в крови, как при введении экзогенных кортикостероидов, так и при эндогенной гиперактивности надпочечников (синдром Кушинга) приводит к нарушению заживления раны. Под влиянием кортикостероидов нарушаются функции нейтрофилов и макрофагов.
6. Синдром Элера-Данлоса – группа редких наследственных нарушений, в основе которых лежит нарушение формирования коллагена (образования перекрестных связей между цепями коллагена), что проявляется повышенной подвижностью суставов, снижением прочности тканей и нарушением заживления ран.
РЕГЕНЕРАЦИЯ КОСТНОЙ ТКАНИ
Регенерация костной ткани при переломе костей может происходить двумя путями в виде:
- первичного костного сращения;
- вторичного костного сращения.
Первичное костное сращение происходит при неосложненном костном переломе, когда костные отломки хорошо сопоставлены и неподвижны, отсутствует инфекция. Сращение начинается с I-го этапа – активации и пролиферации остеобластов в зоне повреждения, прежде всего в периосте и эндосте – формирования остеобластической грануляционной ткани (мягкая мозоль). Она построена по типу обычной грануляционной ткани, то есть состоит из большого количества новообразованных сосудов и клеток, которые по мере дифференцировки и созревания превращаются в костные - остеоциты, которые вырабатывают межклеточное вещество, в результате чего формируется остеоидная ткань (II этап регенерации). На III этапе регенерации происходит отложение солей кальция в остеоидную ткань и формирование твердой костной мозоли, которая по своему строению отличается от костной ткани лишь беспорядочным расположением костных балок. После того как кость начинает выполнять свою функцию и появляется статическая нагрузка, вновь образованная ткань с помощью остеокластов и остеобластов подвергается перестройке, появляется костный мозг, восстанавливается васкуляризация и иннервация (IV этап).
При нарушении местных условий регенерации кости – расстройства кровообращения, обширные оскольчатые диафизарные переломы, подвижность отломков, происходит вторичное костное сращение. Для этого вида сращения характерно образование между костными отломками сначала хрящевой ткани, на основе которой строится костная ткань. Поэтому при вторичном сращении говорят о предварительной костно-хрящевой мозоли, которая со временем превращается в зрелую кость. Вторичное костное сращение, по сравнению с первичным, встречается значительно чаще и полное восстановление занимает гораздо больше времени.
РЕГЕНЕРАЦИЯ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ
В головном мозге новообразования нейроцитов не происходит. В случае их повреждения и гибели восстановление функции возможно лишь за счет внутриклеточной регенерации сохранившихся нейронов. Для клеток нейроглии, особенно микроглии, характерна клеточная форма регенерации, благодаря чему дефекты ткани головного мозга замещаются глиальными (глиозными) рубцами.
РЕГЕНЕРАЦИЯ ПЕРИФЕРИЧЕСКИХ НЕРВОВ
Регенерация периферического нерва происходит за счет центрального отрезка, сохранившего связь с клеткой. Периферический отрезок погибает. Размножающиеся клетки шванновской оболочки погибшего периферического отрезка нерва располагаются вдоль него и образуют футляр, в который врастают регенерирующие осевые цилиндры из проксимального отрезка. Регенерация нервных волокон завершается их миелинизацией и восстановлением нервных окончаний.
Если регенерация нерва в силу тех или иных причин нарушается (значительное расхождение частей нерва, развитие воспалительного процесса), то в месте его разрыва формируется рубец, в котором беспорядочно располагаются регенерирующие осевые цилиндры проксимального отрезка нерва. Такие разрастания называются ампутационными невромами.
РЕГЕНЕРАЦИЯ МЫШЕЧНОЙ ТКАНИ
Гладкие мышцы, клетки которых обладают способностью к митозу и амитозу, при небольших дефектах могут регенерировать достаточно полно. При больших повреждениях гладких мышц происходит рубцевание (неполная регенерация). Кроме того, новообразование гладких мышечных волокон может происходить путем превращения (метаплазии) клеток соединительной ткани.
Поперечнополосатые мышцы регенерируют лишь при сохранении сарколеммы путем почкования. Источником регенерации служат располагающиеся под сарколеммой клетки-сателлиты. Регенерация мышцы сердца при ее повреждении, как и при повреждении поперечнополосатой мускулатуры, заканчивается рубцеванием дефекта.
ОРГАНИЗАЦИЯ
Организация – это процесс замещения соединительной тканью нежизнеспособных тканей и инородных тел. Замещение участка омертвения, экссудата, тромботических масс соединительной тканью происходит в том случае, если массы подвергаются рассасыванию и одновременно в них врастает молодая соединительная ткань, превращающаяся затем в рубцовую.
Об инкапсуляции говорят в тех случаях, когда омертвевшие массы, животные паразиты, инородные тела (шовный материал) не рассасываются, а обрастают соединительной тканью и отграничиваются от остальной части органа капсулой.
Значение процесса организации не однозначное. С точки зрения биологической, являясь приспособительным процессом, организация имеет положительное значение, поскольку ограничивает влияние погибших тканей и инородных тел на организм. С точки зрения клинической практики, организация может иметь отрицательное значение. Например, при организации экссудата в плевральной полости образуются спайки между висцеральной и париетальной плеврой, что нарушает присасывающую функцию грудной клетки и таким образом способствует развитию легочно-сердечной недостаточности. Отрицательное значение имеет и организация экссудата в альвеолах легкого – карнификация, ведущая к уменьшению дыхательной функции легких. При наличии спаек в брюшной полости может развиться кишечная непроходимость. Организация экссудата в мозговых оболочках может нарушать отток ликвора и вести к развитию гидроцефалии.
МЕТАПЛАЗИЯ
Метаплазия – это переход одного вида ткани в другой в пределах одного зародышевого листка. Метаплазия возникает из-за неправильной дифференцировки стволовых клеток. “Новая” метапластическая ткань структурно нормальна, так как имеется четкая клеточная организация. Метаплазия носит приспособительный характер и обычно наблюдается при наличии какого-либо хронического физического или химического раздражения.
Метаплазия наиболее часто наблюдается в эпителии. Примером может служить чешуйчатая (сквамозная) метаплазия (наиболее частый тип эпителиальной метаплазии), при которой однослойный призматический или кубический эпителий заменяется многослойным плоским ороговевающим эпителием. Сквамозная метаплазия наиболее часто наблюдается в эпителии шейки матки и слизистой оболочке бронхов, реже она встречается в эндометрии и мочевом пузыре. В бронхах эта метаплазия развивается при хроническом, реже – остром (коревой бронхит) воспалении.
Железистая метаплазия наблюдается в пищеводе, при этом нормальный многослойный эпителий заменяется железистым эпителием (желудочного или кишечного типа), который секретирует слизь. Причиной обычно является рефлюкс кислого желудочного сока в пищевод. Метаплазия может также происходить в желудке и кишечнике, например, замена желудочной слизистой оболочки кишечной слизистой оболочкой (кишечная метаплазия) или наоборот (желудочная метаплазия). Также железистая метаплазия может наблюдаться в герминативном эпителии яичника в виде формирования серозных и слизистых кист.
Реже метаплазия происходит в соединительной ткани. Самый лучший пример – оссификация в рубцах и других фибробластических пролиферациях. Метаплазия в соединительной ткани, как и эпителиальная метаплазия, может служить доказательством возможности дифференцирования стволовых клеток соединительной ткани в различных направлениях.
Метаплазия реверсивна (обратима).
Положительное значение метаплазии и мотивы отнесения ее к группе компенсаторно-приспособительных процессов обусловлены ее защитной сущностью: когда в изменившихся условиях жизнедеятельности органа или ткани становится невозможным функционирование и выживание присущего ему вида клеток, то оптимальной является, в противоположность их полному отсутствию, замена не характерными, но более приспособленными к патологическим условиям клетками.
В большинстве случаев метаплазия не имеет большого клинического значения, однако, в некоторых органах она может вызывать значительные функциональные нарушения. Например, потеря ресничек и накопление слизи в бронхах может предрасполагать к проникновению инфекции и развитию воспаления легочной паренхимы. Метапластическая ткань структурно нормальна и сама метаплазия не представляет собой опасности в плане развития опухоли. Однако, при возникновении диспластических изменений, которые довольно часто развиваются в участках метаплазии вследствие сопровождающих ее нарушений дифференцировки и детерминированности, риск образования раковой опухоли резко возрастает. Например, сквамозная карцинома может развиваться в метапластическом ороговевающем эпителии бронхов; аденокарцинома может возникнуть в пищеводе из метапластического железистого эпителия.
Для проверки степени усвоения Вами материала по теме "Компенсаторно-приспособительные процессы" просьба ответить на поставленные вопросы в нижеприведенных тестовых заданиях.
ТЕСТОВОЕ ЗАДАНИЕ №153
Выберите один правильный ответ. При вскрытии трупа мужчины, умершего от сердечной недостаточности, при жизни страдавшего цирротической формой туберкулеза легких, отмечено, что масса сердца 420.0 г, толщина стенки правого желудочка 0,8 см. Микроскопически кардиомиоциты увеличены в объеме, ядра их крупные, гиперхромные. Ультраструктурно отмечено увеличение объема и количества цитоплазматических органелл в клетках (митохондрий, миофибрилл), синтетического аппарата (эндоплазматического ретикулума, рибосом и аппарата Гольджи). Наряду с этим, в ряде кардиомиоцитов отмечены дистрофические изменения. В сердце имеет место следующий процесс:
1. атрофия;
2. гипертрофия;
3. гиперплазия;
4. метаплазия;
5. инфаркт.
ТЕСТОВОЕ ЗАДАНИЕ №154
Выберите один правильный ответ. Молодая женщина погибла вскоре после родов в результате сепсиса. На аутопсии матка размерами 22х18х10 см, массой 1200 г. Микроскопически отмечено увеличение объема гладкомышечных волокон, гиперхромия ядер. В матке имел место следующий процесс:
1. рабочая гипертрофия;
2. викарная гипертрофия;
3. коррелятивная (гормональная) гипертрофия;
4. патологическая гипертрофия;
5. защитная гиперплазия.
ТЕСТОВОЕ ЗАДАНИЕ №155
Выберите один правильный ответ. Молодая женщина погибла вскоре после родов в результате сепсиса. На аутопсии селезенка массой 400 г, дряблой консистенции, дает обильный соскоб пульпы. В селезенке имел место следующий процесс:
1. рабочая гипертрофия;
2. викарная гипертрофия;
3. коррелятивная (гормональная) гипертрофия;
4. патологическая гипертрофия;
5. защитная гиперплазия.
ТЕСТОВОЕ ЗАДАНИЕ №156
Выберите один правильный ответ. У мужчины 35 лет, после электроожога в области внутренней поверхности правой кисти сформировался келоидный рубец, а на предплечье - длительно незаживающая язва. Оба эти процесса являются примерами:
1. викарной гипертрофии;
2. репаративной регенерации;
3. патологической регенерации;
4. защитной гиперплазии;
5. метаплазии.
ТЕСТОВОЕ ЗАДАНИЕ №157
Выберите один правильный ответ. При микроскопическом изучении ткани легких ребенка, погибшего в результате коревой пневмонии, установлено, что слизистая бронхов на значительном протяжении представлена многослойным плоским неороговевающим эпителием. Какой процесс обнаружен в бронхах.
1. защитная гиперплазия;
2. метаплазия;
3. патологическая регенерация;
4. патологическая гипертрофия;
5. организация.
ТЕСТОВОЕ ЗАДАНИЕ №158
Выберите один правильный ответ. При вскрытии трупа мужчины, длительно страдавшего болезнью почек (хроническим гломерулонефритом), отмечено, что масса сердца 450,0 г, толщина стенки левого желудочка 2.0 см. Микроскопически в миокарде обнаружены увеличенные в объеме, утолщенные кардиомиоциты с крупными, гиперхромными ядрами, увеличенными в объеме и количестве цитоплазматическими органеллами, выявляемыми при ультраструктурном изучении. Данная морфологическая картина свидетельствует о наличии в миокарде:
1. патологической регенерации;
2. рабочей гипертрофии;
3. патологической гипертрофии;
4. гиперплазии;
5. метаплазии.
ТЕСТОВОЕ ЗАДАНИЕ №159
Выберите один правильный ответ. При вскрытии трупа мужчины, длительно страдавшего болезнью почек (хроническим гломерулонефритом), отмечено, что масса сердца 450.0 г, толщина стенки левого желудочка 2.0 см. Микроскопически в миокарде обнаружены увеличенные в объеме, утолщенные кардиомиоциты с крупными, гиперхромными ядрами, увеличенными в объеме и количестве цитоплазматическими органеллами, выявляемыми при ультраструктурном изучении. Причиной таких структурных изменений является:
1. недостаточность аортального клапана;
2. стеноз устья аорты;
3. общее ожирение;
4. редукция малого круга кровообращения;
5. ренальная (симптоматическая) гипертензия.
ТЕСТОВОЕ ЗАДАНИЕ №160
Выберите один правильный ответ. При вскрытии трупа мужчины, умершего от сердечной недостаточности, при жизни страдавшего цирротической формой туберкулеза легких, отмечено, что масса сердца 420.0 г, толщина стенки правого желудочка 0,8 см. Причиной развития "легочного сердца" в данном случае является:
1. недостаточность аортального клапана;
2. стеноз устья аорты;
3. общее ожирение;
4. редукция малого круга кровообращения;
5. ренальная (симптоматическая) гипертензия.
ТЕСТОВОЕ ЗАДАНИЕ №161
Выберите один правильный ответ. При вскрытии трупа женщины, страдавшей при жизни ревматическим пороком сердца, установлено, что масса сердца 600 г, толщина стенки левого желудочка - 2 см, правого - 0.6 см, полости сердца расширены. Наиболее вероятной причиной таких морфологических изменений является:
1. тиреотоксикоз;
2. стеноз устья аорты;
3. общее ожирение;
4. стеноз левого атрио-вентрикулярного отверстия;
5. недостаточность клапанов легочной артерии.
ТЕСТОВОЕ ЗАДАНИЕ №162
Выберите один правильный ответ. Мужчине 47 лет по поводу коралловидного камня лоханки была удалена правая почка (нефрэктомия). Через несколько лет при контрольном УЗИ (ультразвуковом исследовании) установлено, что левая почка размерами 14х9х6 см, правильной формы, с четкими ровными контурами, без обычной эхогенности. О наличии какого процесса свидетельствуют такие изменения:
1. рабочая гипертрофия;
2. викарная гипертрофия;
3. коррелятивная гипертрофия;
4. гормональная гиперплазия;
5. эксцентрическая атрофия.
ТЕСТОВОЕ ЗАДАНИЕ №163
Выберите один правильный ответ. При исследовании печени больного, погибшего от кровотечения из варикозно расширенных вен нижней трети пищевода, в ней обнаружены крупные узлы, представляющие собой участки гипертрофированных гепатоцитов, окруженных прослойками волокнистой соединительной ткани. Проявлениями какого общепатологического процесса служат описанные изменения:
1. физиологической регенерации;
2. атрофии;
3. реституции;
4. субституции;
5. метаплазии.
ТЕСТОВОЕ ЗАДАНИЕ №164
Выберите один правильный ответ. Женщина, страдавшая сахарным диабетом, обратилась к хирургу с жалобами на наличие длительное время незаживающих язв на коже обеих голеней (трофические язвы). Хирург решил, что данный процесс служит проявлением:
1. атрофии;
2. коррелятивной (гормональной) гипертрофии;
3. патологической регенерации;
4. метаплазии;
5. организации.
ТЕСТОВОЕ ЗАДАНИЕ №165
Выберите один правильный ответ. Молодая женщина обратилась к гинекологу с жалобами на частые, нерегулярные, чрезмерно обильные маточные кровотечения. При обследовании диагностирован склерокистоз яичников, при исследовании соскоба из полости матки - железисто-кистозная гиперплазия эндометрия. Данный вид гиперплазии является разновидностью:
1. реактивной гиперплазии;
2. викарной гиперплазии;
3. заместительной, компенсаторной гиперплазии;
4. гормональной гиперплазии;
5. рабочей гиперплазии.
ТЕСТОВОЕ ЗАДАНИЕ №166
Выберите один правильный ответ. При вскрытии трупа мужчины, умершего от легочно-сердечной недостаточности, обнаружено, что париетальный и висцеральный листки плевры справа спаяны между собой плотными, серовато-беловатыми, волокнистыми, местами разделяемыми при помощи ножа сращениями (спайками). Из анамнеза известно, что умерший неоднократно переносил плеврит. Какой процесс имеет место в данном случае:
1. организация экссудата;
2. метаплазия;
3. метаболическое обызвествление;
4. атрофия;
5. гипертрофия листков плевры.
ТЕСТОВОЕ ЗАДАНИЕ №167
Выберите один правильный ответ. При микроскопическом изучении биоптата бронха больного, длительное время страдавшего хроническим бронхитом, обнаружено, что на отдельных участках слизистая оболочка бронха представлена многослойным плоским эпителием. Это служит проявлением:
1. варианта нормы;
2. гипертрофии;
3. регенерации;
4. атрофии;
5. метаплазии.
ТЕСТОВОЕ ЗАДАНИЕ №168
Выберите один правильный ответ. При микроскопическом исследовании биоптата слизистой оболочки желудка установлено наличие очагов железистой кишечной метаплазии в пилорическом отделе. Наиболее вероятной причиной таких изменений является:
1. злоупотребление алкоголем;
2. нерегулярное питание;
3. рефлюкс желудочного содержимого;
4. рефлюкс кишечного содержимого;
5. болезни печени
ТЕСТОВОЕ ЗАДАНИЕ №169
Выберите один правильный ответ. При микроскопическом исследовании биоптата слизистой оболочки пищевода установлено наличие очагов железистой метаплазии в участке, граничащем с кардиальным отделом желудка. Наиболее вероятной причиной таких изменений является:
1. злоупотребление алкоголем;
2. нерегулярное питание;
3. рефлюкс желудочного содержимого;
4. рефлюкс кишечного содержимого;
5. болезни печени.
ТЕСТОВОЕ ЗАДАНИЕ №170
Выберите один правильный ответ. Во время операции хирург удалил из печени полое образование, стенки которого образованы плотной волокнистой соединительной тканью с наличием белых участков каменистой плотности (обызвествленных). В просвете полости располагался погибший эхинококк. Образование эхинококковой кисты в печени - это результат:
1. атрофии;
2. организации;
3. гипертрофии;
4. опухолевого процесса;
5. метаплазии.
ТЕСТОВОЕ ЗАДАНИЕ №171
Выберите один правильный ответ. Ассистируя во время операции чреспузырной простатэктомии, выполняемой по поводу аденоматозной гиперплазии предстательной железы, молодой врач-уролог был очень удивлен, увидев, что толщина мышечного слоя стенки мочевого пузыря составляет 1.3 см. Немного поразмыслив, он понял, что причиной таких изменений является:
1. гормональная гипертрофия;
2. атрофия;
3. рабочая гипертрофия;
4. гормональная гиперплазия;
5. продуктивное воспаление.
ТЕСТОВОЕ ЗАДАНИЕ №172
Выберите один правильный ответ. У шахтера в результате полученной в забое травмы имеет место обширная рана с дефектом (отсутствием) больших участков эпидермиса, включая базальные герминативные клетки с поверхностные отделы дермы. Хирург не стал ушивать рану наглухо, так как признал невозможным заживление ее первичным натяжением. Основной причиной этого является:
1. полное сопоставление краев раны;
2. отсутствие инородных тел в ране;
3. отсутствие инфекции в ране;
4. невозможность сопоставления краев раны (рваная рана);
5. отсутствие некроза подлежащих тканей.
ТЕСТОВОЕ ЗАДАНИЕ №173
Выберите один правильный ответ. У женщины 20 лет при осмотре шейки матки на передней губе выявлен кровоточащий участок 3х4 см. При микроскопическом исследовании поверхность участка представлена цилиндрическим эпителием. Этот участок является проявлением:
1. патологической регенерации;
2. репаративной регенерации;
3. физиологической регенерации;
4. метаплазии;
5. организации.
ЛЕКЦИЯ № 8
Актуальность темы
Воспаление (inflammatio) – это сложная, комплексная местная сосудисто-мезенхимальная реакция на повреждение ткани, вызванное действием различных агентов.
Воспаление – реакция, выработанная в процессе филогенеза, имеет защитно-приспособительный характер. Она направлена на уничтожение агента, вызвавшего повреждение, и на восстановление поврежденной ткани. В общей патологии человека воспаление принято рассматривать как важнейший "ключевой" общепатологический и вместе с тем биологический процесс. Знание темы необходимо для глубокого понимания сущности большинства заболеваний человека.
Цель обучения – уметь определять макро- и микроскопические признаки воспаления, объяснить причины и механизм развития, оценить его вероятный исход и определить значение для организма.
Для чего необходимо уметь:
- определить макро- и микроскопические проявления альтеративного воспаления, объяснить причины, механизм развития, исход и оценить его значение;
- определить макро- и микроскопические проявления экссудативного воспаления, объяснить причины, механизм развития, исход и оценить его значение;
- определить макро- и микроскопические проявления пролиферативного воспаления, объяснить причины, механизм развития, исход и оценить его значение;
Причины воспаления: физические, химические и биологические факторы.
Физические факторы:
- травма (разрезы, уколы, укусы, ушибы, вибрация, воздействие шума, сдавление);
- ионизирующая, ультрафиолетовая радиация;
- электрическая энергия;
- высокие (огонь) и низкие (холод) температуры.
Химические факторы:
- кислоты;
- щелочи;
- минеральные и органические вещества;
- эндогенные токсины (желчные кислоты, продукты азотистого обмена).
Биологические факторы:
- вирусы;
- бактерии;
- грибы;
- животные паразиты;
- циркулирующие в крови антитела и активированные иммунные комплексы.
Морфология воспаления. Процесс воспаления един и складывается из трех фазовых компонентов – альтерации, экссудации и пролиферации.
АЛЬТЕРАЦИЯ
Альтерация – повреждение ткани, которое морфологически проявляется различного вида дистрофией и некрозом. Повреждение может развиваться непосредственно под воздействием болезнетворного фактора, либо опосредовано – нейрогуморальным путем. В эту фазу воспаления происходит выброс биологически активных веществ – медиаторов воспаления. Это пусковой механизм воспаления.
Томас Люис в 1927 выяснил основные факторы, которые участвуют в развитии острого воспаления. Сильное проведение по коже предплечья тупым предметом вызывает тройной ответ: 1) в течении 1 минуты появляется красная полоса по линии раздражения в результате расширения артериол, капилляров и венул в участке повреждения; 2) одновременно появляется разлитое покраснение в окружающей повреждение ткани в результате вазодилятации; и 3) формируется волдырь из-за экссудации жидкости по линии повреждения. Люис доказал, что вазодилятация в окружающей повреждение ткани ("вспышка", второстепенный признак воспаления) возникает из-за действия местного аксон-рефлекса, а главные компоненты острого воспаления – красная линия и волдырь – независимы от нервных связей в ткани. Люис продемонстрировал, что местное введение гистамина вызывает реакцию, эквивалентную красной линии и волдырю. Это открытие положило основу для понимания роли химических медиаторов при остром воспалении (табл. 1).
Таблица 1
Медиаторы острого воспаления
| Медиатор | Вазодилятация | Увеличение проницаемости | Хемотаксис | Опсонизация | Боль | |
| Немедленное | Отсроченное | |||||
| Гистамин | + | +++ | – | – | – | – |
| Серотонин | + | + | – | – | – | – |
| Брадикинин | + | + | – | – | – | +++ |
| Комплемент 3а | – | + | – | – | – | – |
| Комплемент 3b | – | – | – | – | +++ | – |
| Комплемент 5а | – | + | – | +++ | – | – |
| Простагландины | +++ | + | +? | +++ | – | + |
| Лейкотриены | – | +++ | +? | +++ | – | – |
| Лизосомальные протеазы | – | – | ++1 | – | – | – |
| Кислородные радикалы | – | – | ++1 | – | – | – |
1 Протеазы и содержащие кислород свободные радикалы, высвобождающиеся из нейтрофилов, вызывают отсроченное повышение проницаемости в результате их повреждающего действия на эндотелиальные клетки.
Исследования после экспериментов Люиса показали, что гистамин является одним из многих медиаторов острого воспалительного ответа. Было обнаружено большое количество других медиаторов, но точная роль каждого из них в воспаленной ткани неизвестна; об их действии in vivo можно только догадываться на основе их активности in vitro.
Вазоактивные амины: гистамин и серотонин, высвобождаются из тканевых базофилов и тромбоцитов. У человека гистамин играет более важную роль, чем серотонин; он действует главным образом на венулы, которые имеют H1-гистаминовые рецепторы. Оба эти амина вызывают вазодилятацию и увеличение проницаемости и, вероятно, являются главными агентами, действующими в начальном периоде острого воспалительного ответа. Уровень гистамина уменьшается быстро, в пределах часа после начала воспаления.
Система кининов: брадикинин, конечный продукт системы кинина, формируется в результате действия калликреина на белок-предшественник в плазме (крупномолекулярный кининоген). Калликреин существует в виде неактивной формы (прекалликреин) в плазме и активируется активированным XII фактором (фактор Хагемана) системы свертывания крови. Брадикинин увеличивает сосудистую проницаемость и раздражает болевые рецепторы.
Система свертывания крови: обратите внимание, что система свертывания, ведущая к образованию фибрина, также активируется фактором Хагемана (активированный фактор XII). Фибринопептиды, которые образуются в катаболизме фибрина (фибринолиз), также вызывают увеличение сосудистой проницаемости и являются хемотаксинами для нейтрофилов.
Система комплемента: C5a и C3a, которые образуются при активации комплемента, вызывают увеличение сосудистой проницаемости, стимулируя выброс гистамина тканевыми базофилами. C5a – мощный хемотаксический агент для нейтрофилов и макрофагов. C3b – важный опсонин. C5a активирует липооксигеназный комплекс метаболизма арахидоновой кислоты.
Метаболиты арахидоновой кислоты: арахидоновая кислота – ненасыщенная жирная кислота, содержащая 20 атомов углерода, найденная в фосфолипидах клеточных мембран нейтрофилов, тканевых базофилов, моноцитов и других клеток. При высвобождении арахидоновой кислоты фосфолипазами запускается ряд сложных реакций, в результате чего образуются простагландины, лейкотриены и другие медиаторы воспаления (рис. 1).
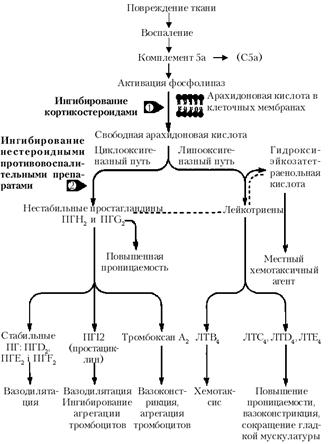
Рис. 1. Метаболиты арахидоновой кислоты и их роль в воспалении
ЛТС4, ЛТD4 и ЛТЕ4 раньше обозначались как медленно реагирующая субстанция анафилаксии (МРС-А).
Факторы нейтрофилов: протеазы и токсические кислородосодержащие свободные радикалы, образующиеся в нейтрофилах, как предполагается, вызывают эндотелиальное повреждение, что приводит к увеличению сосудистой проницаемости.
Другие медиаторы и ингибиторы: существует множество других химических медиаторов острого воспаления, которые здесь не описаны, потому что они играют или незначительную, или сомнительную роль. Существуют также и ингибиторы воспаления, но они недостаточно изучены; возможные ингибирующие факторы включают ингибитор эстеразы C1 (ингибирует систему комплемента) и α1-антитрипсин (ингибирует протеазы).
Медиаторы плазмы крови и клеточного происхождения взаимосвязаны. Действие медиаторов опосредовано рецепторами на поверхности эффекторных клеток. Из этого следует, что смена одних медиаторов другими во времени обусловливает смену клеточных форм в зоне воспаления – от полиморфно-ядерного лейкоцита для фагоцитоза до фибробласта, активируемого цитокинами макрофага, для репарации.
ЭКССУДАЦИЯ
Экссудация – это сложный процесс формирования воспалительного выпота, источниками которого могут быть кровь, лимфа и местные клетки ткани, в которой развивается воспалительный процесс. Основные компоненты воспалительного выпота имеют гематогенное происхождение.
Формирование воспалительного выпота, который носит название экссудат, происходит в результате микроциркуляторных и клеточных реакций.
Экссудат обязательно состоит из двух частей:
- жидкой части, в состав которой входит вода, плазменные белки – альбумины, глобулины, фибриноген, минеральные соли,
- клеточной части, в состав которой входят как клетки гематогенного происхождения – нейтрофилы, лимфоциты, моноциты, гистиоциты, эритроциты, так и клетки местной ткани – макрофаги, эпителиальные, мезотелиальные клетки.
Соотношение жидкой и клеточной части, а также преобладание тех или иных клеточных форм при различных формах воспаления будет различным.
Экссудация – фаза, быстро следующая за альтерацией и выбросом медиаторов. Существует два главных компонента этой фазы воспалительного ответа:
- микроциркуляторные изменения;
- клеточные реакции.
Микроциркуляторные изменения
Вазодилятация и стаз: первое изменение в микроциркуляции – преходящая и незначительная вазоконстрикция, которая затем сменяется выраженной дилятацией артериол, капилляров и венул. Вазодилятация вызывает начальное увеличение кровотока в воспаленной области (гиперемия). Затем развивается стаз, который характеризуется резким снижением кровотока.
Увеличение проницаемости: проницаемость капилляров и венул зависит от состояния межклеточных стыков (пор) между эндотелиальными клетками сосудов. Через поры в норме могут проходить маленькие молекулы (МВ <40000). Путем пиноцитоза осуществляется селективный перенос больших молекул через капилляр в интерстициум. В нормальном капилляре жидкость выходит из микроциркуляторного русла в ткани под влиянием капиллярного гидростатического давления и возвращается обратно под влиянием осмотического давления коллоидов плазмы. В норме, жидкость, которая проникает в ткани из микроциркуляторного русла, является ультрафильтратом плазмы (табл. 2).
Таблица 2
Различия между экссудатом и трансудатом
| Ультрафильтрат плазмы | Трансудат | Экссудат | Плазма | |
| Сосудистая проницаемость | Нормальная | Нормальная | Повышенная | – |
| Содержание белков | Следы | 0-15 г/л | 15-60 г/л1 | 60-70 г/л1 |
| Типы белков | Альбумины | Альбумины | Все2 | Все2 |
| Фибрин | Нет | Нет | Есть | Нет (фибриноген) |
| Относительная плотность | 1.010 | 1.010-1.015 | 1.015-1.027 | 1.027 |
| Клетки | Нет | Нет | Воспаления | Крови |
1 Содержание белка в экссудате зависит от уровня белка в плазме. У пациентов с низким уровнем белка в крови содержание белка в экссудате может быть ниже 15 г/л
2 Все – альбумины, глобулины, комплемент, иммуноглобулины, белки фибринолитической системы, системы свертывания и др.
При остром воспалении наблюдается немедленное (но реверсивное) увеличение проницаемости венул и капилляров, благодаря активному сокращению филаментов актина в эндотелиальных клетках, приводящее к расширению межклеточных пор. К такому же результату может приводить прямое повреждение эндотелиальных клеток токсическими агентами. Через сосуды с нарушенной проницаемостью могут проникать большие количества жидкости и крупномолекулярные белки. Эти изменения проницаемости вызываются различными химическими медиаторами (табл. 1).
Экссудация жидкости
Переход большого количества жидкости из кровотока в интерстициальную ткань вызывает припухлость (воспалительный отек) ткани. Увеличение перехода жидкости из микроциркуляторного русла в ткани из-за увеличения сосудистой проницаемости называется экссудацией. Состав экссудата приближается к составу плазмы (табл. 2); он содержит большое количество белков плазмы, включая иммуноглобулины, комплемент и фибриноген, ввиду того, что эндотелий с повышенной проницаемостью больше не предотвращает проникновение в ткани этих больших молекул. Фибриноген при остром воспалительном экссудате быстро преобразуется в фибрин под влиянием тромбопластинов тканей. Фибрин может обнаруживаться микроскопически в экссудате в виде розовых нитей или пучков. Макроскопически фибрин наиболее хорошо виден на воспаленной серозной оболочке, поверхность которой изменяется от нормальной блестящей до шероховатой, желтоватой, покрытой пленкой и коагулированными белками.
Экссудацию необходимо отличать от трансудации (табл. 2). Трансудация – это процесс увеличенного перехода жидкости в ткани через сосуды с нормальной проницаемостью. Сила, под влиянием которой происходит переход жидкости из кровотока в ткани, обусловлена увеличением гидростатического давления или уменьшением осмотического давления коллоидов плазмы. Трансудат имеет состав, аналогичный составу ультрафильтрата плазмы. В клинической практике идентификация отечной жидкости (трансудат или экссудат) имеет большую диагностическую ценность, так как она обеспечивает определение причины нарушений, например, при исследовании перитонеальной жидкости (при асците).
Экссудация обеспечивает снижение активности повреждаюшего агента путем:
- разведения его;
- увеличения оттока лимфы;
- наводнения плазмой, содержащей многочисленные защитные белки типа иммуноглобулинов и комплемента.
Увеличение лимфатического дренажа способствует переносу повреждающих агентов в регионарные лимфатические узлы, облегчая таким образом защитный иммунный ответ. Иногда при заражении вирулентными микроорганизмами этот механизм может стать причиной их распространения и возникновения лимфангита и лимфаденита.
Клеточные реакции:
Типы вовлеченных клеток: острое воспаление характеризуется активной эмиграцией воспалительных клеток из крови в область повреждения. Нейтрофилы (полиморфноядерные лейкоциты) доминируют в ранней стадии (в первые 24 часа). После первых 24-48 часов в очаге воспаления появляются фагоцитирующие клетки макрофагальной системы и иммунологически активные клетки типа лимфоцитов и плазматических клеток. Однако нейтрофилы остаются преобладающим типом клеток в течение нескольких дней.
Краевое стояние нейтрофилов: в нормальном кровеносном сосуде клеточные элементы сосредоточены в центральном осевом потоке, отделяясь от эндотелиальной поверхности зоной плазмы (рис. 2). Это разделение зависит от нормального тока крови, которое возникает под действием физических законов, влияние которых приводит к накоплению самых тяжелых клеточных частиц в центре сосуда. Так как скорость кровотока в расширенных сосудах при остром воспалении уменьшена, распределение клеточных элементов нарушается.
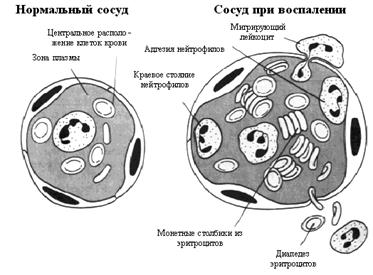
Рис. 2. Изменения в микроциркуляции при воспалении
Капилляры при воспалении расширены, эндотелиальные клетки набухшие, наблюдается образование монетных столбиков из эритроцитов и маргинация и эмиграция нейтрофилов
Эритроциты формируют большие аггрегаты ("монетный столбик" из эритроцитов) (так называемый "слажд"-феномен).
Лейкоциты перемещаются к периферии и вступают в контакт с эндотелием (маргинация, краевое стояние), на котором многие из них адгезируются. Это происходит в результате увеличения экспрессии (появления на поверхности клеток) различных молекул адгезии клеток (САМ, cell adhesion molecules) на лейкоцитах и эндотелиальных клетках. Например, экспрессия бета 2 интегринов (комплекс CD11-CD18), которые включают в себя лейкоцитарный функциональный антиген-1 (LFA-1, leukocyte function antigen-1), увеличивается из-за влияния таких хемотаксических факторов как C5a ("анафилатоксин") комплемента, и лейкотриена В4. Синтез комплементарных CAM-молекул на эндотелиальных клетках аналогично регулируется действиями интерлейкина-1 (IL-1) и TNF (фактор некроза опухоли (tumor necrosis factor), который выявляется и вне опухолей); они включают ICAM 1, ICAM 2 и ELAM-1 (эндотелиальная молекула адгезии лейкоцитов, endothelial leukocyte adhesion molecule).
Эмиграция нейтрофилов: адзегированные нейтрофилы активно покидают кровеносные сосуды через межклеточные щели и проходят через базальную мембрану, попадая в интерстициальное пространство (эмиграция). Проникновение через стенку сосуда длится 2-10 минут; в интерстициальной ткани нейтрофилы двигаются со скоростью до 20 мкм/мин.
Хемотаксические факторы (табл. 1): активная эмиграция нейтрофилов и направление движения зависят от хемотаксических факторов. Факторы комплемента C3a и C5a (образующие в комплексе анафилатоксин) – мощные хемотаксические агенты для нейтрофилов и макрофагов, как и лейкотриен ЛТB4. Взаимодействие между рецепторами на поверхности нейтрофилов и этими "хемотаксинами" увеличивает подвижность нейтрофилов (путем увеличения притока ионов Ca2+ в клетку, который стимулирует сокращение актина) и активирует дегрануляцию. Различные цитокины оказывают активирующую роль в процессах развития иммунного ответа.
Эритроциты попадают в воспаленную область пассивно, в отличие от активного процесса эмиграции лейкоцитов. Они выталкиваются из сосудов гидростатическим давлением через расширенные межклеточные щели вслед за эмигрирующими лейкоцитами (диапедез). При тяжелых повреждениях, связанных с нарушением микроциркуляции, в очаг воспаления может попадать большое количество эритроцитов (геморрагическое воспаление).
Фагоцитоз имеет следующие фазы (рис. 3):
1. Распознавание – первым этапом фагоцитоза является распознавание повреждающего агента фагоцитарной клеткой, которое происходит или непосредственно (при распознавании больших, инертных частиц), или после того, как агент покрывается иммуноглобулинами или факторами комплемента (C3b) (опсонизация). Облегченный опсонином фагоцитоз – механизм, участвующий в иммунном фагоцитозе микроорганизмов. IgG и C3b – эффективные опсонины. Иммуноглобулин, который обладает специфической реактивностью по отношению к повреждающему агенту (специфическое антитело) – наиболее эффективный опсонин. C3b образуется непосредственно в очаге воспаления путем активации системы комплемента. На ранних стадиях острого воспаления, прежде чем развивается иммунный ответ, доминирует неиммунный фагоцитоз, но по мере развития иммунного ответа он замещается более эффективным иммунным фагоцитозом.
2. Поглощение – после распознавания нейтрофилом или макрофагом чужеродная частица поглощается фагоцитарной клеткой, в которой формируется ограниченная мембраной вакуоль, названная фагосомой, которая при слиянии с лизосомами образует фаголизосому.
3. Разрушение микроорганизмов – когда повреждающим агентом является микроорганизм, он должен быть убит, прежде чем произойдет гибель фагоцитирующей клетки. В процессе
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 3259; Нарушение авторских прав?; Мы поможем в написании вашей работы!