
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Законы равновесия
|
|
|
|
Законы термодинамического равновесия определяют условия, при которых процесс переноса любой субстанции (массы, энергии и импульса) приходит к своему завершению.
Движущая сила процесса количественно характеризует отклонение от состояния равновесия.
Условия равновесия необходимы для знания направления переноса и расчета движущей силы процесса.
Состояние системы, при котором перенос субстанций отсутствует, называется равновесным.
Условия равновесия в процессах переноса теплоты определяются измерением температур соприкасающихся фаз. Механическое равновесие (при переносе импульса) обнаруживают по равенству непосредственно измеренных давлений в соприкасающихся фазах.
Процесс перехода вещества (массы) из одной фазы в другую в изолированной системе, состоящей из двух и более фаз, возникает самопроизвольно (без вмешательства извне) и протекает до тех пор, пока между фазами при данных условиях (температуре и давлении) не установится подвижное фазовое равновесие. Оно характеризуется тем, что в единицу времени из первой фазы во вторую и обратно переходит одинаковое число молекул вещества.
Система будет находиться в равновесии до тех пор, пока какое-либо внешнее воздействие не выведет ее из этого состояния.
Условия равновесия
Таким образом, состояние изолированной системы при равновесии определяется только внутренними условиями. Поэтому дифференциалы интенсивных параметров должны быть равны нулю:
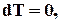 - условие термического равновесия
- условие термического равновесия
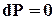 - условие механического равновесия (1)
- условие механического равновесия (1)
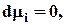 - химическое равновесие
- химическое равновесие
Химический потенциал i – го компонента системы вычисляют как частную производную от внутренней энергии системы U по числу частиц (или молей) этого компонента при постоянных объеме, энтропии и массах других компонентов:
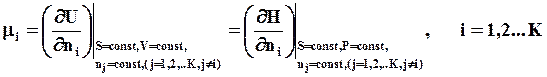 ,
,
где n i – число молей i – го компонента; Н – энтальпия системы.
где Т – температура, Р – давление в системе, 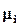 - химический потенциал i – го компонента (i=1,2,…K).
- химический потенциал i – го компонента (i=1,2,…K).
Выражения (1) – условия термического, механического и химического (материального) равновесия системы.
Справедливы утверждения:
а) все самопроизвольные процессы протекают в направлении достижения равновесия;
б) чем в большей степени состояние системы отклоняется от равновесия, тем выше скорость процесса переноса субстанций между фазами.
Из второго закона термодинамики следует, что в самопроизвольных процессах энтропия S системы возрастает и достигает максимума при равновесии, то есть
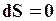 (2)
(2)
в состоянии равновесия системы.
Действительно, энтропию системы можно рассматривать как меру вероятности пребывания системы в данном состоянии, а равновесие для самопроизвольного процесса есть наиболее вероятное состояние.
Уравнения (1) и (2) определяют условия равновесия системы.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 409; Нарушение авторских прав?; Мы поможем в написании вашей работы!