
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Постулаты Бора
|
|
|
|
Итак, модель атома Резерфорда не объясняет устойчивость атома и не объясняет спектр атомов. Однако она подтверждается другими экспериментальными фактами и поэтому ее просто так отбросить нельзя.
Выход из создавшегося тупика был предложен датским физиком Нильсом Бором в 1913 году.
Свои предложения Нильс Бор сформулировал в виде двух постулатов.
1). В атоме существуют так называемые разрешенные орбиты, по которым электрон, двигается хотя и с ускорением, но не излучает электромагнитную энергию. Эти орбиты подчиняются определенным квантовым условиям.
2). Излучение испускается или поглощается атомом лишь при переходе с одной стационарной (разрешенной) орбиты на другую. При этом величина энергии светового кванта равна разности энергий этих стационарных состояний, между которыми совершается квантовый скачок электрона:
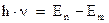 (3)
(3)
Соответственно частота излучения будет равна:
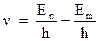
Если принять, что энергия электрона, удаленного на бесконечно большое расстояние от ядра равна нулю, тогда энергия электрона в атоме будет отрицательна (при удалении электрона необходимо совершать положительную работу, сообщая тем самым электрону положительную энергию). Следовательно, выражение для частоты можно переписать как:

Эта формула согласуется со спектроскопическими данными, рассмотренными выше, согласно которым частота линии равна разности термов:
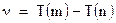
Применение теории Бора к водородоподобным атомам
Для объяснения спектра атомарного водорода Бор, основываясь на своих постулатах, сделал предположение, что в атоме водорода стационарными, разрешенными, устойчивыми орбитами являются только те орбиты, для которых момент импульса равен целому кратному постоянной Планка, деленной на 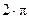 . Т.е.
. Т.е.
 (4)
(4)
где 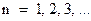 - число, называемое главным квантовым числом.
- число, называемое главным квантовым числом.
Исходя из этих представлений, вычислим радиусы стационарных орбит.
Вращаясь вокруг ядра, электрон испытывает центробежное ускорение  . Поскольку электрон находится на устойчивой орбите, то центробежная сила должна равняться кулоновской силе притяжения к ядру:
. Поскольку электрон находится на устойчивой орбите, то центробежная сила должна равняться кулоновской силе притяжения к ядру:
 (5)
(5)
Но согласно (3.4),  . Следовательно:
. Следовательно:

Для первой водородной орбиты и  получим:
получим:
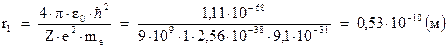
т.е. порядка тех же газокинетических размеров. Таким образом, радиус разрешенных орбит определяется выражением:
 (6)
(6)
Энергия электрона в атоме слагается из его потенциальной энергии в электрическом поле ядра:
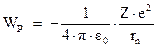
и кинетической энергии его движения по орбите со скоростью  :
:

Таким образом, полная энергия электрона  будет равна:
будет равна:
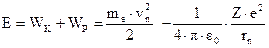
Но согласно (3.5) ‑ 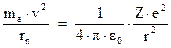 . Отсюда вытекает, что
. Отсюда вытекает, что
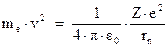
Таким образом, выражение для полной энергии примет вид:

 Подставляя в это выражение значение радиуса (3.6), получим:
Подставляя в это выражение значение радиуса (3.6), получим:
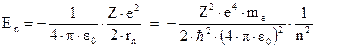
Таким образом, схема энергетических уровней атома водорода будет иметь вид, изображенный на рис. 4.
При переходе электрона из одного энергического состояния в другое испускается квант электромагнитной волны с энергией:
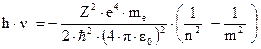
Следовательно, частота излучаемого света будет равна:

Сравнивая полученное выражение с формулой Бальмера (3.2), получим, что постоянная Ридберга должна определяться выражением:
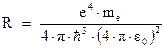
Таким образом, получено теоретическое выражение для константы Ридберга. Подставим сюда значения универсальных констант:
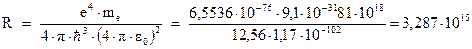
Полученное теоретическое значение очень хорошо согласуется с экспериментальным значением, найденным из спектроскопических данных.
Итак, теория атома Бора в применении к атому водорода дала поразительно точные результаты.
Теория Бора показала, что к внутриатомным процессам нельзя применять понятия классической физики.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 473; Нарушение авторских прав?; Мы поможем в написании вашей работы!