
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вольтамперометрія
|
|
|
|
Вольтамперометричні методи – це електрохімічні методи аналізу, які ґрунтуються на одержанні і вивченні залежності сили струму, що проходить через аналізований розчин, від прикладеної напруги. Цю залежність називають полярографічною кривою.
Основоположник полярографічного аналізу – чеський вчений Я. Гейровський (1922 р.)
Прилад для проведення аналізу (полярографічна установка) показана на
рис. 4.2. Мікроелектродом є електрод з ртуть капаючим мікроелектродом чи закріпленою краплею ртуті, може бути і платинова пластина – стаціонарна або така, що обертається. Анодом виступає або шар ртуті або насичений каломельний електрод (Hg, Hg2Cl2, KCl).
























 1
1
 |
 3 4
3 4
 | ||||||
 | ||||||
 | ||||||
 |
Hg

 5
5
Hg 6
Рис. 4.2. Схема полярографічної установки
1- джерело струму;
2- реостат, за допомогою якого змінюють напругу;
3- гальванометр;
4- мікроелектрод з резервуаром Hg;
5- електролізер з досліджуваним розчином;
6- макроанод з шару Hg.
 Метод вольтамперометрії ґрунтується на процесі електролізу. При електролізі досліджуваного розчину підвищують напругу і фіксують зміну струму, що проходить через розчин. Одержану графічну залежність називають полярограмою.
Метод вольтамперометрії ґрунтується на процесі електролізу. При електролізі досліджуваного розчину підвищують напругу і фіксують зміну струму, що проходить через розчин. Одержану графічну залежність називають полярограмою.
 І, А
І, А



 Iд C D
Iд C D



 А
А
В
 E1/2 E, B
E1/2 E, B
Рис. 4.3. Полярографічна крива
Для збільшення електропровідності вводять фонові електроліти в досліджуваний розчин, які мають нижчий потенціал розрядження, ніж аналізована речовина: KCl, NaCl, NH4Cl, NaOH, HCl.
Полярографічна крива має три ділянки:
ділянка АВ: збільшується напруга; І= const; відбувається розрядження індиферентних електролітів;
точка В: досягається потенціал визначуваної речовини; при цьому відновлюються Меn+ до вільних металів, які зі ртуттю утворюють амальгаму Ме/Hg;
ділянка ВС;
точка С: граничний дифузійний струм Ід;
ділянка СD: подальше збільшення напруги не змінює сили струму.
Фізичний зміст граничного дифузійного струму:
у розчині за досягнення І кожен з йонів, що підходить до поверхні електрода розряджається, тому швидкість розрядження лімітується швидкістю дифузії з товщі розчину до поверхні електрода.
Полярографічна крива математично описується рівнянням Гейровського-Ільковича:
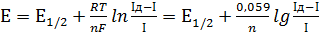 , (8)
, (8)
де 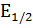 – потенціал півхвилі; Ід – граничний дифузійний струм; І – струм в окремій точці полярографічної кривої.
– потенціал півхвилі; Ід – граничний дифузійний струм; І – струм в окремій точці полярографічної кривої.
В якісному аналізі використовують потенціал півхвилі 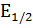 для ідентифікації речовини, оскільки він є характеристикою окремого йона (залежно від виду фонового електроліту). Так, як катіону Pb2+ потенціал півхвилі в присутності фонових електролітів, має такі значення:
для ідентифікації речовини, оскільки він є характеристикою окремого йона (залежно від виду фонового електроліту). Так, як катіону Pb2+ потенціал півхвилі в присутності фонових електролітів, має такі значення:
в 0,1 М KCl (-0,39 B)
в 0,1 М HCl (-0,45 B)
в 0,1 М NaOH (-0,90 B)
Кількісний аналіз проводять, одержуючи полярографічну криву для аналізованого розчину і стандартного (метод порівняння) і вимірюють висоту полярографічних хвиль, яка пропорційна концентрації речовини, що розряджається на електроді (рис. 4.4).


 І, А 1 Сст
І, А 1 Сст
 Сх
Сх
 2
2
hx hст
Е, В
Рис. 4.4. полярографічні криві досліджуваного (1) і стандартного (2) розчинів.


Застосовують і метод добавок та метод градуювального графіка (за висотою полярографічної кривої).
Можна скористатися і рівнянням Ільковича:
Ід= 605 n D1/3m2/3τ1/6C, (9)
n- кількість електронів, які приймають участь в електролізі;
D- коефіцієнт дифузії, см2/с;
m- маса Hg, яка витікає з капіляра за 1 с, мг;
τ- період капання (час формування краплі ртуті), с;
C- концентрація йонів, які відновлюються, ммоль-екв/л.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1308; Нарушение авторских прав?; Мы поможем в написании вашей работы!