
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Конспект лекцій. Восстановление работы жизненно важных органов человека после
|
|
|
|
Восстановление работы жизненно важных органов человека после
ПО ТЕМЕ ЛЕКЦИИ №4
КОНТРОЛЬНЫЙ СРЕЗ ЗНАНИЙ
Лабораторная диагностика
«ЗДОРОВЫЙ ОБРАЗ ЖИЗНИ И ЕГО ФОРМИРОВАНИЕ.
ВРЕДНЫЕ ПРИВЫЧКИ, ИХ ВЛИЯНИЕ НА ЗДОРОВЬЕ ЧЕЛОВЕКА. ПРОФИЛАКТИКА ВРЕДНЫХ ПРИВЫЧЕК.»
(УКАЗАТЬ ОДИН ПРАВИЛЬНЫЙ ОТВЕТ)
Вариант-1
Подготовила: Казарцева Е.В.
2011 г.
1. Здоровый образ жизни - это образ:
А. активный, организованный
Б. трудовой, закаливающий
В. сохраняющий здоровье
Г. все вышеперечисленное
2. Виды здоровья:
А. физическое
Б. психическое
В. нравственное
Г. все верно
3. Элементы ЗОЖ:
А. рациональный режим труда и отдыха
Б. искоренение вредных привычек
В. оптимальный двигательный режим, личная гигиена
Г. все вышеперечисленное
4. Вредные привычки:
А. курение, употребление алкоголя
Б. личная гигиена, труд
В. двигательная гимнастика
Г. закаливающие процедуры
5. Способствуют распространению вредных привычек:
А. психологический климат в семье
Б. внушаемость
В. безвольность и слабоволие
Г. все верно
6. Влияние алкоголя на кровь проявляется:
А. образованием тромбов из эритроцитов
Б. склеиванием эритроцитов
В. разрушением стенок кровеносных сосудов
Г. все вышеперечисленное
7. Алкоголь «держится» в тканях мозга:
А. от 8 до 30 суток
Б. от 8 до 40 суток
В. от 8 до 45 суток
Г. от 8 до 50 суток
8. При курении развиваются:
А. прогрессирует спазм сосудов
Б. повышается свертываемость крови
В. страдают органы пищеварения
Г. все верно
9. Никотин вызывает выброс в кровь гормонов тревоги, грусти:
А. ацетилхолин
Б. адреналин, серотонин
В. гистамол
Г. тироксин
10. Пороки у детей, рожденных от пьющих матерей:
А. пороки развития сердца
Б. болезни почек
В. порок развития половых органов
Г. все верно
11. При курении часто поражаются дыхательные пути в виде:
А. хронического колита
Б. хронического бронхита
В. хронического панкреатита
Г. хронического артрита
12. Радиоактивные вещества, содержащиеся в сигаретах:
А. натрий, калий
Б. цинк
В. полоний, висмут
Г. кальций
хронического отравления возможно через:
А. 1 – 2 года
Б. 3 – 4 года
В. 5 – 6 лет
Г. 5 – 8 лет
14. Наркотические вещества - это:
А. морфин
Б. кокаин, анаша
В. план, марихуана
Г. все вышеперечисленное
15. Что больше всего страдает при употреблении наркотиков:
А. головной мозг
Б. желудок
В. сердце
Г. печень
ЭТАЛОН ОТВЕТОВ
| 1 ВАРИАНТ | 2 ВАРИАНТ | 3 ВАРИАНТ |
| 1 – Г | 1 – | 1 – |
| 2 – Г | 2 – | 2 – |
| 3 – Г | 3 – | 3 – |
| 4 – А | 4 – | 4 – |
| 5 – Г | 5 – | 5 – |
| 6 – Г | 6 – | 6 – |
| 7 – А | 7 – | 7 – |
| 8 – Г | 8 – | 8 – |
| 9 – Б | 9 – | 9 – |
| 10 – Г | 10 – | 10 – |
| 11 – Б | 11 – | 11 – |
| 12 – В | 12 – | 12 – |
| 13 – Г | 13 – | 13 – |
| 14 – Г | 14 – | 14 – |
| 15 – А | 15 – | 15 – |
КРИТЕРИЙ ОЦЕНКИ:
100-90% правильных ответов – «5» - не более 2 ошибок
89-80% правильных ответов – «4» - не более 3 ошибок
79-70% правильных ответов – «3» - не более 4 ошибок
менее 70% правильных ответов – «2» - более 4 ошибок
з дисципліни
«АТОМНА І ЯДЕРНА ФІЗИКА»
для студентів спеціальності
«радіофізика і електроніка»
6.040204
Донецьк
ВСТУП
В Х1Х і на початку ХХ століття були відкриті нові фізичні явища, які фізика неспроможна була пояснити. Наприклад, спектр випромінювання абсолютно чорного тіла, спектр випромінювання найпростішого атома водню, зміщення ліній сонячного спектра в сторону довгих ліній під час сонячного затемнення, явище фотоефекта та інші. Крім того, залишалося не вирішеним питання природи світла. Це спричинило кризу в фізиці, яка неспроможна була пояснити ці явища.
В результаті не простого виходу з цього кризового стану зародилася квантова фізика з її новими принципами, що дало можливість більш глибокого вивчення навколишнього світу: була зۥясована природа відкритих раніше явищ, передбачені нові явища, нові властивості рідких та твердих тіл, відкриті нові частинки, античастинки, та інше. Все це сприяло розвитку нових технологій: створенню транзистора, обчислювальної машини, нових матеріалів, знання про клітину досягло молекулярного рівня. В XX столітті наука розвивалася швидкими темпами. Квантова фізика стала інженерною наукою. З`явилися нові розділи фізики – ядерна фізика, астрофізика, біофізика, нанофізика. В становленні кантової фізики велику роль відіграло вивчення найпростішого атома – атома водню.
Важливу роль в подоланні кризи в фізиці відіграла гіпотеза М. Планка (1900 р.), згідно з якою, частинка, як осцилятор, змінює свою енергію не неперервно, а порціями (квантами) Еn = nħω, чисельно рівними ћω, де ћ – стала Планка, ω – частота електромагнітної хвилі, n = 1,2,3,.. Ця гіпотеза, з часом була експериментально обгрунтована, стала одним із принципів квантової фізики.
Тема №1. МОДЕЛІ АТОМА, ЇХ АНАЛІЗ.
Слово «атом» означає неподільний, тобто, атом – це найменша неділима частинка матерії. Таке уявлення про атом передавалося древніми (Демокріт, ІV cтоліття до нашої ери) із покоління в покоління, аж поки не зۥявилися експериментальні факти, які поставили під сумнів неподільність атому. Після відкриття явища електролізу стало очевидним, що атом ділиться на дві заряджені частини. Тоді зۥявилися моделі атома, в яких автори намагалися представити відносний рух та взаємодію двох частин атома.
МОДЕЛЬ ТОМСОНА. Атом представляє собою кульку з рівномірно розподіленою густиною, в середині якої під дією сил, подібним силам пружності, рухаються електрони (булка з ізюмом). В такому випадку електрон здійснює коливальний рух з однією частотою. Якщо навіть ввести ще силу тертя, то, крім основної частоти, зۥявляться обертони (гармоніки). Таким чином, спектр випромінювання атома за моделлю Томсона складається з основної частоти і гармонік, розташованих на одинакових відстанях. Такий спектр зовсім не збігається з експериментальним.
МОДЕЛЬ РЕЗЕРФОРДА.(1905 р.) Ця модель створена за результатами експериментальних досліджень розсіювання альфа-частинок на атомах (в металі). Припускаючи справедливість закону Кулона та закону збереження момента імпульса на відстанях зрівняних з розмірами атома, Резерфорд отримав залежність кількості розсіяних альфа-частинок dN від кута розсіювання θ: dN· Sin4 (θ/2) = Const. (1)
Аналіз результатів розсіювання альфа-частинок показав наступне.
Значна більшість розсіяних частинок задовольняла залежності (1), тому Резерфорд зробив висновок, що закони класичної фізики справедливі на відстанях зрівняних з розмірами атома.
Незначна кількість частинок (≈1: 10000) розсіювалася під тупими кутами. На підставі цих експериментальних результатів (мала кількість частинок і тупий кут розсіювання)) він дійшов висновку, що атом, як кулька, «пустий» (бо багато частонок майже не відхиляються, пролітаючи крізь атом), вся маса атома зосереджена в дуже малому обۥємі (приблизно в 10000 раз меншому за розмір атома), тому так мало частинок відхиляється під тупим кутом. Цю частину атома, де зосереджена вся маса атома, він назвав ядром атома з додатнім зарядом. Тоді за наочним прикладом сонячної системи він запропонував так звану планетарну модель атома водню: навколо важкого ядра по колу обертається електрон. Але така модель атома не може пояснити його існування, тому що електрон, як заряджена частинка, що обертається навколо ядра з прискоренням, згідно закону електродинаміки, випромінює електромагнітні хвилі, тому кінетична енергія електрона буде зменшуватися, і з часом він упаде на ядро.
МОДЕЛЬ БОРА – РЕЗЕРФОРДА (1913 р.) До моделі Резерфорда атома водню Бор добавив два постулати. Перший - електрон, знаходячись в стаціонарному стані, не випромінює (не поглинає) електромагнітні хвилі. Другий - він тільки тоді випромінює (поглинає) електромагнітні хвилі, коли переходить із одного стаціонарного стану з енергією Е2 в інший – з енергією Е1. Величина випроміненої енергії дорівнює Е2-Е1= ΔЕ12 = ћω21. Це математичний запис гіпотези Планка. Виходячи з висновку Резерфорда про справедливість законів класичної фізики в обۥємі атома, Бор використав закон збереження енергії, закон Кулона, закон збереження момента імпульса та ΔЕ = ћω = 2πћс ∕λ для знаходження повної енергії електрона E, його швидкості v, радіуса орбіти r і довжини хвилі випромінювання λ (чотири рівняння – чотири невідомі).
1) Е = Ек+Еп =  , де Z –номер елемента в таблиці елементів, е, m - заряд
, де Z –номер елемента в таблиці елементів, е, m - заряд
і маса електрона, v, r - його швидкість і радіус орбіти, Ze – заряд ядра;
2)  , 3) М = m v r = n ћ = Const, n – номер стану електрона, n = 1,2,3,…∞.
, 3) М = m v r = n ћ = Const, n – номер стану електрона, n = 1,2,3,…∞.
4) ΔE = Ek – En = ћω = 2πћс/λ.
Розвۥязання цієї системи рівнянь дає такі вирази для Е, v, r і λ:
 , (2)
, (2)
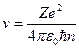 , (3)
, (3)
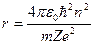 , (4)
, (4)
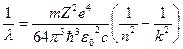 . (5)
. (5)
Отримані результати дають підстави зробити наступні висновки:
- енергія електрона в атомі водню має дискретні значення, оскільки в формулу для
Еn входять сталі величини (m,e,Z,π,εo,ћ), а n приймає цілі значення (1,2,3….), En
визначає стаціонарний стан електрона, найбільша по модулю енергія електрона при n = 1;
- швидкість електрона і радіус його орбіти теж приймають дискретні значення, найменший
радіус орбіти електрона при n = 1, він називається Боровським радіусом і дорівню ≈0,05нм;
- радіус орбіти електрона збільшується з ростом числа n по квадратичному закону;
- з ростом номера елемента (Z) зменшуеться радіус орбіти електрона (необхідно
зазначити, що формули для Еn, v, r справедливі для атому водню, Не+,Li++, для
багатоелектронних атомів ці формули вказують лише на тенденцію зміни Еn,v,r від маси
m, чисел Z і n), так, для атома урану U92 (Z=92) радіус орбіти найближчого до ядра
електрона приблизно в 92 рази менший радіуса Бора, на зменшення відстані між
електроном і ядром з ростом числа Z вказують явище К-захвату для важких елементів;
- для атома водню (Z=1) найбільшу швидкість має електрон при n = 1, з рогстом Z
швидкість електрона зростає і при Z > 200 вона зрівняється зі швидкістю світла, таким чином
модель Бора-Резерфорда пояснює обмеженість кількості елементів таблиці;
- за фізичним смислом величина
ΔE = Ek – En =  , при n=1, k = ∞ і Z =1 ΔE =
, при n=1, k = ∞ і Z =1 ΔE = 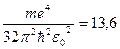 еВ
еВ
є енергією іонізації атома водню, вона є сталою величиною і називається сталою Рідберга,
позначається R∞ = me4/ 32π2εo2ћ2 = 13,6 електрон-вольт, з урахуванням вищезазначеного
енергію електрона в атомі можна записати як:
Еn = - Z2R∞/n2; (6)
- модель Бора-Резерфорда пояснила експериментальний спектр випромінювання спектр
випромінювання атому водню (формула(5)) дискретний і складається із серій. Серія
ліній, що лежить в ультрафіолетовому діапазоні, утворюється при переходах електрона із
станів к = 2,3,4,5,… ∞ в стан n = 1, це серія Лаймана, переходам електрона із к = 3,4,5,.. ∞
в n = 2 відповідає серія Бальмера, а із к = 4,5,6,..∞ в n = 3 - серія Пашена, вона лежить в
інфрачервоному діапазоні оптичного випромінювання.
На рис. № 1 стрілками зображена схема переходів електрона атома водню з верхніх енергетичних рівнів на нижні (стала Рідберга на рисунку позначена буквою А). На рис.№ 1 головна лінія серіїї Бальмера позначена буквою Нα, друга лінія - Нβ.

Рис. № 1.
Експериментальна перевірка теорії моделі Бора-Резерфорда атома водню показала, що для повної відповідності теорії і результатів експерименту необхідно в формулах для енергії, радіуса орбіти електрона і довжини хвилі випромінювання масу електрона замінити на приведену масу
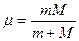 , де М - маса ядра атома. Символ ∞ в R∞ означає, що стала Рідберга розрахована для випадку, коли ядро атома знаходиться в стані спокою (нескінченно важке).
, де М - маса ядра атома. Символ ∞ в R∞ означає, що стала Рідберга розрахована для випадку, коли ядро атома знаходиться в стані спокою (нескінченно важке).
ЕКСПЕРИМЕНТАЛЬНА ПЕРЕВІРКА МОДЕЛІ
Франк і Герц поставили дослід з метою визначити механізм зіткнень електронів з атомами, тобто – чи будуть зіткнення пружними чи непружними в залежності від енергії прискорених електронів. Ідея досліду полягала в наступному: - порівняти енергію прискорених електронів термоелектронної емісії («вільних» електронів (*)) до і після зіткнення їх з атомами (о). Якщо енергія електрона атома змінюється неперервно (приймає будь-яке значення), то і енергія «вільного» електрона після непружного зіткнення з атомом теж буде змінюватися неперервно, він буде передавати електрону атома будь-яку енергію. У випадку дискретного спектру електрона атома зіткнення з «вільними» електронами будуть пружними при будь-яких значеннях енергії Е «вільних» електронів, крім енергії «вільних» електронів Е* =∆Е1n = Z2R∞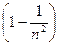 . Тільки при цій умові «вільний» електрон може передати, а електрон атома прийняти енергію Е*, відбудеться передача енергії, зіткнення буде непружним, атом перейде в збуджений стан (О) і потім, випромінивши фотон, перейде в основний стан (о). При всіх інших значеннях енергії «вільних» електронів передача енергії не відбувається, оскільки електрон атома таких значень енергії не має (6). Дослід проводився на трьохелектродній лампі, заповненій атомами (газ). Катод (К) був джерелом «вільних» електронів, сітка (С) виготовлена в формі циліндра (див. рис. № 2).
. Тільки при цій умові «вільний» електрон може передати, а електрон атома прийняти енергію Е*, відбудеться передача енергії, зіткнення буде непружним, атом перейде в збуджений стан (О) і потім, випромінивши фотон, перейде в основний стан (о). При всіх інших значеннях енергії «вільних» електронів передача енергії не відбувається, оскільки електрон атома таких значень енергії не має (6). Дослід проводився на трьохелектродній лампі, заповненій атомами (газ). Катод (К) був джерелом «вільних» електронів, сітка (С) виготовлена в формі циліндра (див. рис. № 2).  - вектори сил електричного поля, що діють на електрон на ділянці катод-сітка і сітка-анод відповідно.
- вектори сил електричного поля, що діють на електрон на ділянці катод-сітка і сітка-анод відповідно.
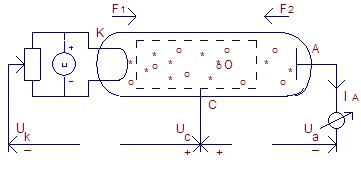
Рис. № 2.
Для спрощення формул покладемо Uk = 0, тоді на ділянці катод – сітка «вільний» електрон отримує від електричного поля енергію Е* = еUс. Поки еUc < (Е1-E2) = 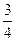 Z2R∞ «вільний» електрон не передасть енергію еUc атому, оскільки цієї енергії недостатньо для того, щоб перевести електрон атома з основного стану (n = 1) в наступний збуджений стан (n = 2, див. Рис.N 1). Для цього необхідна енергія
Z2R∞ «вільний» електрон не передасть енергію еUc атому, оскільки цієї енергії недостатньо для того, щоб перевести електрон атома з основного стану (n = 1) в наступний збуджений стан (n = 2, див. Рис.N 1). Для цього необхідна енергія 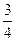 Z2R∞. Тому «вільний» електрон з енергією e(Uc-Ua) < еUc <
Z2R∞. Тому «вільний» електрон з енергією e(Uc-Ua) < еUc < 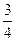 Z2R∞, пролетівши по інерції простір сітки (де різниця потенціалів дорівнює нулю), в змозі пролетіти простір сітка – анод. Таким чином, з ростом еUc анодний струм буде збільшуватися до тих пір, поки еUc не стане рівним
Z2R∞, пролетівши по інерції простір сітки (де різниця потенціалів дорівнює нулю), в змозі пролетіти простір сітка – анод. Таким чином, з ростом еUc анодний струм буде збільшуватися до тих пір, поки еUc не стане рівним 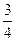 Z2R∞. При цій умові «вільний» електрон при зіткненні з атомом передає енергію електрону атома, з залишком енергії порядка ≈ кТ (енергія теплового руху) він не взмозі долетіти до аноду, бо кТ<< е(Uc – Ua), тому при еUc1=
Z2R∞. При цій умові «вільний» електрон при зіткненні з атомом передає енергію електрону атома, з залишком енергії порядка ≈ кТ (енергія теплового руху) він не взмозі долетіти до аноду, бо кТ<< е(Uc – Ua), тому при еUc1= 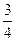 Z2R∞ анодний струм буде зменшуватись. При подальшому збільшенні потенціалу сітки Uс енергія «вільних» електронів буде збільшуватися, після зіткнення з атомом у них буде залишатися енергія ΔE = [eUс -
Z2R∞ анодний струм буде зменшуватись. При подальшому збільшенні потенціалу сітки Uс енергія «вільних» електронів буде збільшуватися, після зіткнення з атомом у них буде залишатися енергія ΔE = [eUс -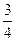 Z2R∞] > е(Uc- Ua), достатня для протидії гальмуючій силі електричного поля, щоб долетіти до анода. Струм знову буде зростати до тих пір, поки еUс2 не стане рівним
Z2R∞] > е(Uc- Ua), достатня для протидії гальмуючій силі електричного поля, щоб долетіти до анода. Струм знову буде зростати до тих пір, поки еUс2 не стане рівним 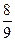 Z2R∞, тоді «вільний» електрон віддасть при зіткненні свою енергію еUc2 електрону атома (електрон перейде в стан n = 3). Залишка енергії (≈ кТ) недостатньо для того, щоб долетіти до аноду, струм знову буде зменшуватися. Аномалії анодного струму при Uc1, Uc2 ….однозначно вказують на дискретний спектр енергій електрона атома. Цей дослід підтвердив справедливість моделі Бора-Резерфорда атома водню і гіпотези Планка.
Z2R∞, тоді «вільний» електрон віддасть при зіткненні свою енергію еUc2 електрону атома (електрон перейде в стан n = 3). Залишка енергії (≈ кТ) недостатньо для того, щоб долетіти до аноду, струм знову буде зменшуватися. Аномалії анодного струму при Uc1, Uc2 ….однозначно вказують на дискретний спектр енергій електрона атома. Цей дослід підтвердив справедливість моделі Бора-Резерфорда атома водню і гіпотези Планка.
Аномалії анодного струму можна виявляти іншим способом. Як відомо, в трьохелектродній вакумній лампі залежність анодного струму від потеціалу сітки визначається формулою Річардсона І~ Uc3/2. При непружних зіткненнях електронів ця залежність І(Uc) не виконується, і на прямій ℓgI = 3/2ℓgUc спостерігаються аномолії при Uc= Uc1 і Uc= Uc2.
Експериментальна перевірка моделі показала, що:
- енергія електрона атома водню змінюється дискретно;
- експериментальні значення довжин хвиль повністю співпадають з розрахованими значеннями по
формулі 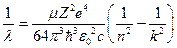 ,
,
модель Бора-Резерфорда пояснює експериментальний спектр випромінювання атому водню;
- експериментальне значення єнергії іонізації атома водню повністю співпадає з
розрахованим значенням по формулі R = μ e4/ 32π2εo2ћ2 ;
- розрахований за формулою (4) розмір атома водню співпадає з розміром, визначеним за
законами молекулярної фізики.
Крім ліній спектру (5) були знайдені слабо інтенсивні рядом розташовані інші лінії, які, як згодом виявилося, належать ізотопам водню - дейтерію і трітію. За формулою R = μ e4/ 32π2εo2ћ2 була розрахована стала Планка ћ, зачення якої співпало із значенням, отриманим із досліду по фотоефекту.
Таким чином, модель Бора- Резерфорда повністю пояснила всі відомі на той час експериментальні факти про атом водню. Це був тріумф моделі, але в неї були і недоліки:
- модель була не послідовна, так як базувалася з одної сторони на класичних законах
(де передбачається неперервна зміна енергії, швидкості, радіусу орбіти), а з другої
сторони - використовувала формулу Планка ΔE = Ek – En = ћω, за якою енергія частинки
змінюється дискретно;
- модель була справедлива тільки для одного атому водню та іонів Не+, Li++ , і зовсім не
пояснювала спектри випромінювання інших атомів;
- модель не могла пояснити різну інтенсивність ліній випромінювання атома водню.
Необхідно зазначити, що Зоммерфельд розв′язав систему рівнянь, на яких базується модель Бора-Резерфорда, в сферичній системі координат і отримав формулу для енергії електрона в такому вигляді:
Е =  , де nеф= nr + nθ +nφ. (7)
, де nеф= nr + nθ +nφ. (7)
З отриманих Зомерфельдом формул траекторії руху електрона навколо ядра, слідує, що форма траекторії електрона в атомі задежить від значень чисел nθ і nφ, При nθ = nφ = 0
форма траекторії руху електрона представляє коло, а в інших випадках - еліпс.
Одне й те ж значення енергії електрона при nеф>1 можна отримати по різному, наприклад, nеф = 2 можна отримати при nr = 1, nθ = 1, nφ= 0, або nr = 2, nθ = nφ = 0. Таким чином, одному й тому ж значенню енергії відповідає дві форми траекторії руху електрона - коло й еліпс. Такий стан електрона був названий виродженим, так цей термін ввійшов у фізику.
Перед фізиками постала задача - створити таку теорію атома, яка б була справедлива для будь-якого атома. Розглянемо, як створювалася така теорія.
Контрольні питання до теми №1.
- В чому полягають відмінності в моделях Томсона і Резерфорда, з яких причин вони були відкинуті?
- Які закони і припущення (постулати) лежать в основі моделі Бора-Резерфорда?
- В чому полягає непослідовність моделі Бора-Резерфорда?
- Які знання про атом водню були отримані з моделі Бора-Резерфорда?
- Який фізичний смисл має стала Рідберга R∞?
- Чи може електрон в атомі водню знаходитися від ядра на відстані, меншій ніж радіус Бора?
- Чому дорівнює енергія взаємодії електрона і ядра в атомі водню?
- При якій умові частота обертання електрона навколо ядра ωо буде дорівнювати частоті випромінювання ωв = (Еn+1 – En)/ћ?
- Вивести формулу квантування орбіт електрона в атомі водню, використовуючи формулу для площі еліпсу S = π
 = Const.
= Const. - Знайдіть межі серії Бальмера (найменшу і найбільшу довжину хвиль).
- Які експериментальні результати досліду Резерфорда дали йому підстави сформулювати планетарну модель атома водню?
12. Чому модель Резерфорда атома водню була відхилена?
Тема №2. МОЛЕКУЛЯРНО-ХВИЛЬОВИЙ ДУАЛІЗМ
1. Формула Ейнштейна.
Матерія, як об′єктивна реальність, існує в двох формах – в формі поля і в формі речовини.
Речовина складається з атомів (частинок), енергія яких, згідно гіпотези Планка, змінюється дискретно Еn = ћωn. Однією з характеристик частинки – є її маса (m). Поле складається з хвиль, їх важливою характеристикою – є довжина хвилі (λ). Сукупність частинок, хвиль або частинок і хвиль разом утворюють фізичну систему, основною характеристикою якої - є енергія Е, яка складається з енергій окремих хвиль, частинок та енергій їх взаємодій. Крім того, фізична система характеризується середньо квадратичною флуктуацією енергії - < δЕ2>. Причиною флуктуації енергії частинок є їх хаотичність руху, а причиною флуктуації енергії хвиль - хаотичність їх фаз. Фізичну систему можна описувати за допомогою різних параметрів. Так, в термодинаміці фізична система описується температурою (Т), об′ємом (V), тиском (Р), енергією (Е), ентальпією, ентропією та ін., елементи фізичної системи не конкретизуються. Електродинаміка вивчає електромагнітні хвилі як елементи фізичної системи. Така фізична система характеризується енергією електромагнітного поля, довжиною хвилі, імпульсом хвилі, хвильовим вектором. Молекулярна фізика вивчає системи, які складаються з частинок, і характеризуються - масою частинки, імпульсом, енергією та ін. Термодинаміка дає наступну формулу для середньо - квадратичної флуктуації енергії фізичної системи:
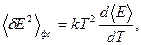 де <E> середнє значення енергії фізичної системи. (8)
де <E> середнє значення енергії фізичної системи. (8)
В електродинаміці середньо квадратичні флуктуації енергії фізичної системи в інтервалі частот dω визначаються такою формулою:
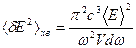 , де V - об′єм фізичної системи. (9)
, де V - об′єм фізичної системи. (9)
В молекулярній фізиці не було виведено формулу для < δЕ2>ч. Ейнштейн вивів формулу для < δЕ2>ч, враховуючи гіпотезу Планка, отримав:
< δЕ2>ч = ћω<E> (10)
Середнє значення енергії фізичної системи <E> = ρ ωV dω, де ρω – спектральна густина енергії випромінювання абсолютно чорного тіла в інтервалі частот dω, за гіпотезою Планка вона дорівнює:
 =
= 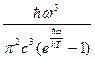 . (11)
. (11)
Підставимо (11) в <E> = ρ ωV dω і отримаємо  . (12)
. (12)
Використовуючи (8) і (12), Ейнштейн отримав вираз для середньо квадратичної флуктуації енергії фізичної системи:
< δЕ2>фс = 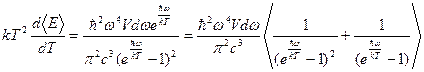 =
=
=  (13)
(13)
Таким чином, середньо квадратичні флуктуації енергії фізичної системи складаються із середньо квадратичної флуктуації енергії системи частинок і середньо квадратичної флуктуації енергії системи хвиль.
Отриманий результат можна розуміти так, що фізична система має одночасно дві властивості - властивості частинок і властивості хвиль. Це означає, що частинка повина мати властивості хвилі, а хвиля – властивості частинки. Як відомо, тільки сполучення цих властивостей дає можливість пояснити властивості світла (наприклад, явище фотоефекту).
З формули (13) видно, що на високих частотах (ультрафіолет) флуктуації енергії частинок більші за флуктуації енергії хвиль (< δЕ2>ч > < δЕ2>хв), тобто, хвилі поводять себе як частинки. На коротких хвилях фізична система проявляє корпускулярні властивості. На малих частотах (радіохвилі) навпаки - < δЕ2>ч < < δЕ2>хв (хвилі поводять себе як хвилі, а не як частинки), фізична система проявляє хвильові властивості.
2. Гіпотеза де Бройля.
При аналізі формули Ейнштейна (13) постає питання: при яких характеристиках частинки вона буде мати властивості хвилі, і при яких характеристиках хвилі вона буде мати властивості частинки? Де Бройль сформулював гіпотезу, згідно якої частинка буде мати властивості хвилі, а хвиля - властивості частинки тоді, коли енергія і імпульс частинки будуть дорівнювати відповідно енергії і імпульсу хвилі: 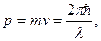
 . Хвиля, якою описуються хвильові властивості частинки, визначається формулою ψ(r,t) =
. Хвиля, якою описуються хвильові властивості частинки, визначається формулою ψ(r,t) =
= ψoeі(ωt – kr), де k – хвильовий вектор,│ k │=  . ψ(r,t) - це плоска монохроматична хвиля, ці хвилі отримали назву хвиль де Бройля. Розглянемо деякі властивості хвиль де Бройля.
. ψ(r,t) - це плоска монохроматична хвиля, ці хвилі отримали назву хвиль де Бройля. Розглянемо деякі властивості хвиль де Бройля.
Довжина хвилі:  , де
, де  .
.
Фазова швидкість хвилі: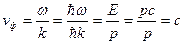 , зазначимо, що фазова швидкість
, зазначимо, що фазова швидкість
відноситься до величин, які принципово не спостерігаються.
Групова швидкість хвилі де Бройля vг = , групова швидкість хвилі
, групова швидкість хвилі
дорівнює швидкості частинки.
В рівнянні закону збереження моменту імпульса електрона в атомі водню mvr = nћ
зробимо заміну mv = 2πћ/ λ і отримаємо: 2πr = n λ. Це означає, що електрон в атомі
водню може обертатися тільки по такому колу, довжина якого дорівнює цілому
числу хвиль де Бройля.
Для підтвердження або спростування гіпотези було поставлено досить багато дослідів. Всі вони підтвердили гіпотезу де Бройля. Давно було відоме таке явище як інтерференція, властиве тільки хвилям. В досліді замість оптичних хвиль брали електрони, які прискорювалися електричним полем з потенціалом U. На фотоплівці отримували таку ж картину світлих і темних ділянок, як із оптичними променями.
Знайдемо умови, при яких має місце інтерференція електронів. Для цього в формулі інтерференції d∙Sin φ = k λ/2 замінемо характеристику хвилі λ на характеристику частинки m.
З формули р2/2m = e∙U знайдемо імпульс електрона і прирівняємо його імпульсу хвилі:
р = 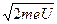 , звідси λ =
, звідси λ =  . Вираз для λ підставимо в формулу інтерференції
. Вираз для λ підставимо в формулу інтерференції
d∙Sin φ = k λ/2 і отримаємо: d∙Sin φ = 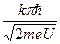 . В отриманій формулі відсутня довжина хвилі, явище інтерференції спостерігається для електронів тільки з такою енергією еU, щоб
. В отриманій формулі відсутня довжина хвилі, явище інтерференції спостерігається для електронів тільки з такою енергією еU, щоб  . В цьому випадку електрони ведуть себе як хвилі і на екрані дають таку ж картину інтерференції, як і оптичні хвилі. Треба мати на увазі наступне: картину інтерференції можна спостерігати тільки при великій кількості електронів, це означає, що функція де Бройля має статистичний характер.
. В цьому випадку електрони ведуть себе як хвилі і на екрані дають таку ж картину інтерференції, як і оптичні хвилі. Треба мати на увазі наступне: картину інтерференції можна спостерігати тільки при великій кількості електронів, це означає, що функція де Бройля має статистичний характер.
Реально хвиль де Бройля не існує, не можна виміряти частоту хвилі де Бройля, її амплітуду.
Вона введена як допоміжний символ і не відноситься до величин, які безпосередньо вимірюються.
Але її знання дає можливість визначити значення величин, які можна експериментально виміряти.
В результаті тривалих дискусій вчені дійшли висновку, що хвилі де Бройля слід розглядати як хвилі ймовірності, тобто інтенсивність хвилі де Бройля в якому-небуть місці простору пропорційна ймовірності знайти частинку в цьому місці. Інтенсивність хвилі де Бройля дорівнює квадрату модуля функції │ψ(r,t)│2 = ψ*(r,t) ψ(r,t) = ψ*о ψо = Const. Це означає, що для хвилі де Бройля, яка описує хвильові властивості вільної частинки, рівноймовірно знайти частинку в будь-якому місці простору. У випадку руху частинки в довільних силових полях її стан описується не функцією де Бройля, а більш складною комплексною функцією, яка називається хвильовою функцією.
3. Співвідношення невизначенностей Гейзенберга.
Частинки і хвилі мають свої особливості. Частинка локалізована в просторі, її положення задається координатами. Для хвилі не можна вказати координати її знаходження, вона нескінченна.
Якщо хвилю обмежити в просторі або в часі, хвиля не буде монохроматичною, з'явиться сукупність хвиль. Тоді виникає питання, де знаходиться частинка, хвильові властивості якої описуються хвилею де Бройля? Відповідь на це питання дав Гейзенберг. Треба скласти всі хвилі, хвильові вектори яких лежать в інтервалі kх і kх +Δkх. Сума цих хвиль дає хвильовий пакет. Наймеша ширина пакета знаходиться як відстань між координатами Δх = х2 – х1, в яких похідна від функції пакета дорівнює нулю. Розрахунок дає таку залежність:
Δх∙ Δрх ≥ 2πћ. (14)
Аналогічна залежність має місце і для інших напрямків. Це співвідношення отримало назву - принцип або співвідношення невизначенностей Гейзенберга для координати і імпульса. Чим точніше вимірюється координата частинки, тим більша стає похибка визначення її імпульса: якщо Δх = 0, то Δрх = ∞ і навпаки.
Із цього принципа невизначенностей можна зробити ряд висновків.
Принципово одночасно неможливо знати координату Х і імпульс частинки Рх.
Частинка, яка має хвильові властивості, не має траекторії, бо для побудови траекторії необхідно одночасно (t = 0) знати імпульс і координату.
Частинка не може знаходитися в стані спокою.
Енергію частинки з хвильовими властивостями не має сенсу ділити на кінетичну і потенціальну (треба одночасно знати імпульс і координату), а визначати її як повну енергію.
Крім вищезазначеного співвідношення було отримане співвідношення невизначенностей Гейзенберга для енергії та часу:
ΔЕ∙ Δt ≥ 2πћ. (15)
Це співвідношення означає, що чим коротше час існування стану з енергією Е, тим з меншою визначенністю можна говорити про енергію цього стану, і навпаки. Якщо стан стаціонарний (Δt → ∞), то ΔЕ → 0, енергія такого стану визначена з великою точністю.
Контрольні питання до теми № 2.
1. Який висновок можна зробити з формули Ейнштейна (13)?
2. Сформулюйте гіпотезу де Бройля?
3. Наведіть приклади експериментальної перевірки гіпотези де Бройля
4. Які властивості притаманні хвилям де Бройля?
5. Яким чином було отримано співвідношення невизначенностей для імпульса і координати?
6. Покажіть, що частинка з хвильовими властивостями не має траекторії.
7. Користуючись формулою (14), докажіть, що електрон не може входити до складу ядра,
розмір ядра ≈ 10 – 15м.
8. Чим обумовлені флуктуації енергії частинок і хвиль?
9. Який смисл має функція де Бройля?
10. Покажіть, що металева кулька диаметром 1мм не має хвильових властивостей.
11. Середня енергія частинок, з яких складається фізична система, за статистичною фізикою
визначається формулою 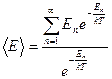 . Доведіть, що
. Доведіть, що 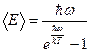 , якщо
, якщо 
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 823; Нарушение авторских прав?; Мы поможем в написании вашей работы!