
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічні будівельні блоки
|
|
|
|
РОЗДІЛ 2
Лекція 3, 4
План
2.1 Хімічні зв'язки й взаємодії між молекулами
2.2 Білки
2.3 Нуклеїнові кислоти
2.4 Вуглеводи
2.5 Ліпіди
Тільки чотири класи органічних речовин мають загальне біологічне значення: білки, нуклеїнові кислоти, вуглеводи та ліпіди. Вони є структурними і функціональними елементами живої матерії
2.1 Хімічні зв'язки й взаємодії між молекулами
В органічних молекулах атоми зв'язані ковалентно; орбіталі сусідніх атомів перекриваються, так що формально виникає загальна пара електронів. Якщо один зі зв'язаних атомів більш електрофільний (оксиген, нітроген), то максимум електронної щільності зміщується ближче до цього атома та утворюється полярна група, що має дипольний момент (наприклад, –С=О або – ОН).
 |
Органічні молекули можуть з'єднуватися ковалентними зв'язками. Іонний зв'язок заснований на електростатичній взаємодії між негативно зарядженою групою однієї молекули (наприклад, – СОО– або –РО3Н2–) і позитивно зарядженою групою (наприклад, NH3+) іншої молекули. Особливо важливим видом дипольних взаємодій є водневі зв'язки. Атом гідрогену, пов'язаний із сильно електронегативним атомом (О, N), здобуває такий сильний позитивний заряд (виникає диполь!), що може утворити другий зв'язок з іншим електронегативним атомом (рис. 2.1).
Рис. 2.1. Утворення водневого зв'язку. Водневі зв'язки між молекулами води (1), між органічною молекулою й водою (2) і між двома органічними, наприклад білковими, молекулами (3)
Взаємодії Лондона-Ван-дер-Ваальса - це слабкі сили притягання між неполярними молекулами або частинами молекул. Коливання атомів (наприклад, електричні моменти, створювані електронами) або груп атомів (наприклад, теплові вібрації) індукують подібні ж коливання в сусідніх молекулах (резонанс). Неполярні молекули та частини молекул (наприклад, вуглеводневі ланцюги), якщо вони перебувають у полярному розчині (такому, як вода), міцно втримуються разом (гідрофобні взаємодії). Це обумовлено тим, що неполярні молекули та частини молекул не взаємодіють із молекулами води. Тому у водяному розчині вони порушують гомогенну структуру води в результаті розриву водневих зв'язків, що приводить до підвищення впорядкованості системи (зменшенню ентропії). Водневі зв'язки утворюються знову, і або відбувається видалення неполярних молекул з розчину (утворення масляної плівки на поверхні води), або навколишня вода стискає ці молекули один з одним так, щоб площа зіткнення виникаючого гідрофобного простору з полярним розчином залишалася мінімальної (кулька).
Молекули з гідрофільною (іонізованою або полярною) і гідрофобною частинами (наприклад, ліпіди,) називаються амфіпатичними. У водяних розчинах гідрофобні частини молекул стискуються в замкнутий шар, у той час як гідрофільні частини повертаються до полярного розчинника та вступають із ним у взаємодію.
2.2 Білки
Білки (протеїни) являють собою макромолекули з молекулярною масою від 10 000 до декількох мільйонів.
Основні функції білків у живих системах:
1. Структурна, будівельна (креатин - білок волосся, нігтів, луски і т.д.);
2. Каталітична - білки ферменти (амілаза, трипсин);
3. Транспортна (гемоглобін, що транспортує кисень, транспортні білки, що переносять речовини через клітинну мембрану);
4. Скорочувальна (актин і міозин - скорочувальні білки м'язів);
5. Регуляторна (білок-репресор, що регулює активність транскрипції);
6. Інформаційна – білки-гормони (інсулін);
7. Захисна - білки-антитіла імунної системи;
8. Енергетична, запасна (білок молока – казеїн, яєчний альбумін);
9. Рецепторна (родопсин);
10. Білки-токсини (у змій, бактерій);
11. Білки-антибіотики (у рослин).
2.2.1 Амінокислоти
Структурними блоками білків служать амінокислоти. Молекула амінокислоти має одночасно аміногрупу (- NH2) і карбоксильну групу (– СООН) (рис. 2.2). Крім значного числа амінокислот, що лише зрідка зустрічаються в білках, існує 20 протеїногенних амінокислот, з яких в основному побудовані все білки.
Протеїногенні амінокислоти є α-амінокислотами та мають L -конфігурацію.
По будові бічного ланцюга (R на рис. 2.2) амінокислоти розділяють на 7 груп:
1) аліфатичні нейтральні (наприклад, гліцин);
2) аліфатичні гідроксиамінокислоти (наприклад, серин);
3) сірковмісні (наприклад, цистеїн);
4) кислі амінокислоти і їхні аміди (наприклад, аспарагінова кислота та ін.);
5) основні (наприклад, лізин та ін.);
6) ароматичні та гетероароматичні (наприклад, фенілаланін й ін.);
7) імінокислоти (пролін).

Рис. 2.2 – Амінокислоти - загальна формула
2.2.2 Хімічна структура пептидів і білків
Аміногрупа однієї амінокислоти здатна вступати в реакцію з карбоксильною групою іншої амінокислоти. Формально така реакція протікає з виділенням води (рис. 2.3), молекула, що утвориться при цьому, представляє собою пептид, а зв'язок – СО – NH – називається пептидним зв'язком. Подальше приєднання амінокислот за допомогою пептидних зв'язків приводить до побудови поліпептидного ланцюга з бічними ланцюгами амінокислот у вигляді відгалужень (R на рис. 2.3). Поліпептидний ланцюг полярний, він містить вільну NH2-гpyпу на амінному кінці (N -кінці) і вільну СООН-групу на протилежному, карбоксильному, кінці (С -кінці). Дипептиди містять два, трипептиди - три, олігопептиди від 2 до 10, поліпептиди - більше 10 амінокислотних залишків.

|
Рис. 2.3. Пептиди. Формальна схема синтезу дипептиду (В) в результаті утворення пептидного зв'язку між двома амінокислотами
Білки являють собою поліпептиди, у молекулу яких входять від 100 до декількох тисяч амінокислот, з молекулярною масою понад 10 000 і діаметром молекули від 5 до 100 нм. Протеїдами називають білкові сполуки з додатковим компонентом (простетичною групою) - залізопротеїди, фосфопротеїди, хромопротеїди та ін.
2.2.3 Первинна структура та конформація білків
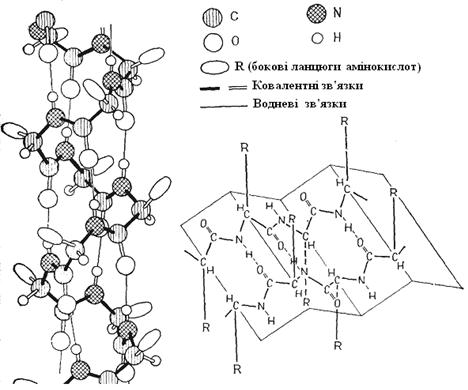
Первинною структурою називають амінокислотну послідовність поліпептидного ланцюга (розташування в ній амінокислотних залишків). Первинна структура специфічна для кожного білка (рис. 2.4) і визначається генетичною інформацією, тобто закодована в ДНК. Від первинної структури залежать всі властивості та функції білка. Так, специфічна дія ферменту вимагає зовсім певної послідовності амінокислот.
| |
| А | Б |

| |
| Г | В |
Рис. 2.4. Конформації. А - вторинна структура білка (α-спіраль); Б - вторинна структура білка (складчастий шар); В - третинна структура білка (глобула); Г - четвертинна структура білка (олігомер, що включає 4 протомери)
Конформація - це певна тривимірна форма поліпептидного ланцюга. Ланцюги звичайно скручені, складені або зігнуті. Конформація (вторинна, третинна й четвертинна) визначається первинною структурою. Вторинна структура виникає в результаті утворення водневих зв'язків між –СО– і NH2– гpyпами двох пептидних зв'язків усередині одного поліпептидного ланцюга (спіральні конфігурації) або між двома поліпептидними ланцюгами (складчасті шари). Зі спіральних конфігурацій найпоширеніша α-спіраль (рис. 2.4), що утримує 3,6 амінокислотних залишки в кожному витку та має крок (висоту витка за віссю спіралі) 0,54 нм. СО– група кожного пептидного зв'язку з'єднана тут водневим зв'язком з NH– групою третьої з найближчих пептидних зв'язків. У складчастому шарі поліпептидні ланцюги лежать паралельно на відстані 0,465 нм, утворюючи плоску конфігурацію, складену на зразок гармошки (рис. 2.4).
Третинна структура в глобулярних білків утвориться, коли: спіральні й неспіральні ділянки поліпептидного ланцюга складаються в тримірне утворення кулястої форми - глобулу(рис. 2.4). Третинна структура стабілізується зв'язками між бічними ланцюгами амінокислот, насамперед ковалентними дисульфідними зв'язками між залишками цистеїну, а також іонними, водневими зв'язками і гідрофобними взаємодіями.
Нерідко декілька однакових або різних поліпептидних ланцюгів, що називають протомерами, поєднуються в одне ціле - олігомер. Ця четвертинна структура фіксується іонними й водневими зв'язками, гідрофобними взаємодіями між бічними ланцюгами поліпептидів.
У глобулярних білків декілька протомерів із третинною структурою утворюють загальну округлу четвертинну структуру (наприклад, гемоглобін: 4 протоміри = 1 тетрамір, (рис. 2.4). Денатурація - це найчастіше необоротна, значна втрата специфічної структури (від четвертинної до вторинної) і біологічної активності. Вона може бути викликана хімічними впливами (обробка солями важких металів, сечовиною, солями гуанідина, спиртом, ацетоном, кислотами, лугами й т.п.), високою температурою (вище 45°С), опроміненням (УФ, рентген, радіоактивність), ультразвуком, високим тиском і т.п.
2.2.4 Фізико-хімічні властивості білків
Завдяки своїм кислим карбоксильним групам й основним аміногрупам амінокислоти являють собою амфоліти й утворюють амфотерні іони. У кислому розчині молекула білка заряджена позитивно, у лужному - негативно. Десь у проміжку перебуває ізоелектрична точка, у якій позитивні й негативні заряди врівноважують один одного. Протоплазма клітини звичайно слаболужна (рН близько 8), тому сумарний заряд білків негативний. Нижче ізоелектричної точки переважають позитивні заряди, а в самій цій точці заряд мінімальний.
2.2.5 Вплив екологічних факторів на білковий обмін
З їжею людині необхідне надходження 10 незамінних амінокислот. При їхній відсутності формується дефіцит певних білків. Для синтезу ряду важливих білків (у тому числі гемоглобіну) крім амінокислот необхідне залізо. У деяких регіонах Африки при достатку заліза в ґрунтах і рослинах у населення поширена анемія (недокрів'я), обумовлена дефіцитом білків у харчуванні. При потраплянні живих організмів у середовища з екстремальними умовами - кислотності, концентрації важких металів у воді або їжі, відбувається денатурація деяких білків і порушення їхніх функцій.
2.2.6 Білки - показники стану здоров'я
Концентрація гемоглобіну в крові - показник стану кровотворної системи та організму в цілому. Присутність білків у сечі свідчить про порушення фільтруючої функції нирок. Реакції Пірке й Манту засновані на взаємодії антигенів з білками-антитілами. Формування імунітету (природного й штучного) засновано на синтезі білків-антитіл.
2.3 Нуклеїнові кислоти
Нуклеїнові кислоти – макромолекули з молекулярною масою від 10000 до декількох мільйонів. Вони є надзвичайно важливими функціональними елементами: ДНК (дезоксирибонуклеїнова кислота) - носій генетичної інформації - перебуває в хромосомах клітинного ядра еуокаріотичних організмів і в еквівалентних структурах мітохондрій, хлоропластів, прокаріотичних організмів і багатьох вірусів, наприклад, у плазмідах; РНК (рибонуклеїнова кислота) служить для передачі та реалізації генетичної інформації в більшості клітинних систем. У багатьох вірусів РНК виконує функцію первинного носія генетичної інформації.
2.3.1 Мононуклеотиди
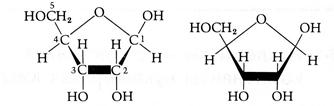
Будівельними блоками нуклеїнових кислот служать мононуклеотиди. Кожен мононуклеотид складається з однієї пуринової або піримідинової основи, пентози (цукру з п'ятьма атомами вуглецю) і залишку фосфату. Кожна пуринова або піримідинова основа зв'язана своїм атомом 9-N або 1-N з атомом 1-C пентози, утворюючи нуклеозид. У мононуклеотиді атом 5'-C пентози нуклеозиду етерифікований фосфатом (рис. 2.5, табл. 2.1).

| 
| |
| А | Б | |
| b- D -рибоза b- D -2-дезоскирибоза | ||
| ||
| В | ||
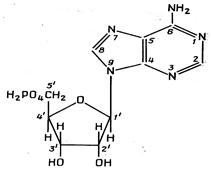 АМР АМР
|  UMP UMP
| |
| Г | ||
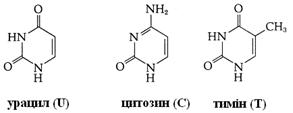
Рис. 2.5. Структурні блоки нуклеїнових кислот. А. Пуринові основи: аденін (Ade), гуанін (Gua). Б. Піримідинові основи: цитозин (Cyt), урацил (Ura) и тимін (Thy). В. Пентози: рибоза (Rib) і дезоксирибоза (dRib). Г. Мононуклеотиди: аденозинмонофосфат (AMP), урідинмонофосфат (UMP)
Таблиця 2.1
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 624; Нарушение авторских прав?; Мы поможем в написании вашей работы!