
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислота Основание Амфолит
|
|
|
|
Офіційний вісник України вiд 27.06.2003 - 2003 р., № 24, стор. 49, стаття 1133
HCl Cl−
HCOOH HCOO−
CH3COOH CH3COO−
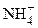 NH3
NH3
H2CO3 
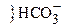

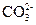
H3O+ H2O

H2O OH−
Обратимые реакции с переносом протона р от кислоты НА к основанию В называют кислотно ─ основными полуреакциями:
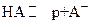 (3.1)
(3.1)
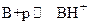 (3.2)
(3.2)
Кислота и получившееся при отдаче протона основание составляют сопряженную
пару. В уравнениях (3.1) и (3.2) это НА и А−, ВН+ и В.
Очевидно, что реакции (3.1) и (3.2) в растворах неосуществимы: кислота может отдать протон только в присутствии акцептора протона. Все вещества лишь потенциально могут быть кислотами или основаниями. Проявить свои кислотные или основные свойства они могут лишь в протолитической реакции, объединяющей полуреакции (3.1) и (3.2):
НА + В  ВН+ + А− (3.3)
ВН+ + А− (3.3)
кислота 1 основание 2 кислота 2 основание 1
Согласно уравнению (3.3), при взаимодействии кислоты и основания образуются новые кислота и основание ─ «нейтрализации» в смысле исчезновения кислоты и основания нет.
Одним из компонентов протолитической реакции может быть растворитель, например, вода, которая относится к амфипротным растворителям, обладающим как кислотными, так и основными свойствами.
Важнейшей особенностью амфипротных растворителей является способность к передаче протона от одной молекулы растворителя к другой:

В случае воды: 
Процессы, в которых одна молекула растворителя проявляет свойства кислоты, а другая ─ основания, называют автопротолизом. Характеристикой равновесия автопротолиза является константа автопротолиза. Константа автопротолиза воды 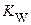 или
или 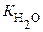 называется ионным произведением воды.
называется ионным произведением воды.
При взаимодействии с амфипротными растворителями растворенные вещества могут проявлять как кислотные, так и основные свойства. Например, в воде:
1. 
2. 
3. 
4. 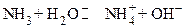
Вторая и третья реакции в рамках теории Аррениуса называются реакциями гидролиза, который является частным случаем кислотно - όсновного равновесия и представляет собой реакцию диссоциации заряженных оснований (например, основания  - реакция 2) и кислот (например, кислоты
- реакция 2) и кислот (например, кислоты 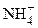 - реакция 3) в воде.
- реакция 3) в воде.
Кислотно ‑ όсновное титрование – быстрый и точный количественный метод определения веществ, обладающих кислотными или основными свойствами.
Методом определяют десятки неорганических и сотни органических кислот и оснований различных типов. Кроме того, существует ряд методик количественного определения ионов металлов и неметаллов кислотно ─ όсновным титрованием.
В основе метода при титровании в водных растворах лежит протолитическая реакция:
Н3О+ + ОН─  2Н2О
2Н2О
В расчетных формулах (кроме уравнений реакций) для упрощения вместо иона гидроксония Н3О+ обычно пишут Н+, помня, что в растворе протон существует в сольватированном состоянии. Для простоты расчетов также полагают коэффициенты активности равными единице.
Титрантами в ацидиметрии являются стандартные растворы HCl и H2SO4 (реже – HClO4 или CH3COOH), а в алкалиметрии – стандартный раствор NaOH. Поскольку точное содержание этих реагентов в промышленных реактивах неизвестно, то из них вначале приготавливают растворы с приблизительно известной концентрацией. Стандартизацию (точное определение концентрации) этих растворов проводят по стандартным веществам, химический состав которых точно известен и которые химически устойчивы на воздухе
В ацидиметрии это безводная сода Na2CO3 или бура Na2B4O7·10H2O:
Na2CO3 + HCl =NaHCO3 + NaCl
Na2CO3 + 2HCl =2NaCl + H2O + CO2↑
Na2B4O7 + 2HCl + 5H2O= 2NaCl + 4H3BO3
а в алкалиметрии – гидрофталат калия COOHC6H4COOK, щавелевая H2C2O4·2H2O или бензойная (C6H5COOH) кислоты:
COOHC6H4COOK + NaOH = NaOOHC6H4COOK + H2O
H2C2O4·2H2O + 2NaOH = Na2C2O4 + 4H2O
C6H5COOH + NaOH= C6H5COONa + H2O
Концентрация стандартных растворов обычно составляет 0.05‑0.5 моль/л, а титруемые растворы часто разбавляют до концентраций порядка 0.01 моль/л.
Для выбора подходящего кислотно – оснόвного индикатора, с помощью которого регистрируют КТТ, в кислотно - оснόвных титрованиях строят, как правило, логарифмические кривые титрования в координатах рН (– lg[H+]) = f (τ). Вычисление концентрации ионов водорода обычно производят с точностью до двух значащих цифр. Такая точность вполне достаточна для выбора индикатора и оценки индикаторных погрешностей титрования.
Расчет и построение кривых титрования.
Различают три типа кривых кислотно ‑ όсновного титрования:
1. титрование сильной кислоты сильным основанием (или наоборот)
2. титрование слабой кислоты сильным основанием
3. титрование слабого основания сильной кислотой
(слабую кислоту слабым основанием (или наоборот) титровать нельзя)
Основными точками на кривой титрования являются: точка начала титрования, точка эквивалентности и несколько точек до и после нее, включая точки начала и конца скачка (кривой) титрования.
Кривые титрования одноосновных кислот. Расчет кривых титрования возможен с учетом и без учета разбавления титруемого раствора в процессе титрования. Последний вариант применяют, как правило, когда концентрация титранта намного больше концентрации титруемого вещества.
Титрование сильной кислоты сильным основанием. До начала титрования раствор содержит только титруемую кислоту. При титровании сильной кислоты равновесная концентрация ионов водорода равна аналитической концентрации кислоты: [H+] =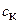 , где
, где 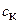 - молярная концентрация или молярная концентрация эквивалента (нормальная концентрация) кислоты
- молярная концентрация или молярная концентрация эквивалента (нормальная концентрация) кислоты
До ТЭ значение рН практически определяется только ионами водорода за счет неоттитрованной сильной кислоты. Для расчета равновесной концентрации [H+], в зависимости от соотношения концентраций и объемов титранта и титруемого вещества,
используют варианты одного из следующих уравнений
 , (1)
, (1)
где индекс «к» относится к кислоте, а индекс «щ» – к щелочи.
Если разбавлением титруемого раствора можно пренебречь, то
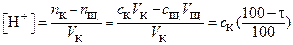 (2)
(2)
Поскольку рН = ─ lg[H+], то после преобразований вышеприведенные уравнения имеют вид
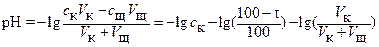 (3)
(3)
и
 (4)
(4)
За ТЭ наблюдается только избыток титранта. Равновесная концентрация гидроксид ионов [OH─] рассчитывается по одному из нижеприведенных вариантов уравнения 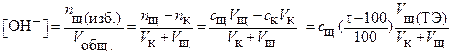 (5)
(5)
Значение рН рассчитывают, исходя из константы автопротолиза: рН = Кw ─ рОН,
по одному из вариантов следующего уравнения
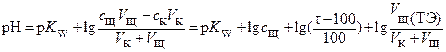 (6)
(6)
Без учета разбавления объема титруемого раствора уравнение (6) преобразуется к виду
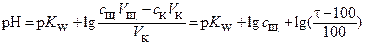 (7)
(7)
Пример. Расчет кривой титрования 0.1 М раствора HCl 0.1 М раствором NaOH без учета разбавления объема титруемого раствора. До ТЭ расчет значений рН раствора проводится по уравнению(4), а за ТЭ ─. по уравнению (7).
| t, % | pH | ||||
| % | моль/л | ||||
| избыток | HCl | ||||
| 0.1 | |||||
| 0.01 | |||||
| 0.001 | |||||
| 99.9 | 0.1 | 0.0001 | точка начала скачка титрования | ||
| 100 (ТЭ) | 10–7 | ||||
| избыток | NaOH | ||||
| 100.1 | 0.1 | 0.0001 | точка конца скачка титрования | ||
| 0.001 | |||||
| 0.01 |
Исходя из полученных данных, построим кривую титрования, откладывая по оси ординат значения рН титруемого раствора, а по оси абсцисс – степень оттитрованности τ.
Следует обратить внимание на тот факт, что при титровании 0.001 М HCl 0.001 М раствором NaOH скачок титрования будет не в интервале рН 4–10, а уже только в интервале рН 6–8, т.е. лишь на 2 единицы pH. Титрование сильно разбавленных растворов заметно сложнее.
Титрование слабой кислоты сильным основанием (на примере титрования уксусной кислоты стандартным раствором едкого натра). При этом следует помнить, что:
А) равновесные концентрации [Н3О+] ≠ 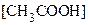
Б) в процессе титрования образуется буферный раствор, состоящий из смеси слабой кислоты  и сопряженного основания
и сопряженного основания  (из смеси слабой кислоты и ее соли);
(из смеси слабой кислоты и ее соли);
В) в ТЭраствор содержит только основание  (анион кислоты) в количестве, равном количеству титруемой кислоты.
(анион кислоты) в количестве, равном количеству титруемой кислоты.
. Поэтому схема (план) расчета значения pH для каждой точки кривой титрования включает:
1. Определение состава раствора
2. Рассмотрение возможных протекающих реакций
3. Вывод расчетных формул, исходя из значений:
– константы (констант) кислотности
– константы (констант) όсновности, аналитических и равновесных концентраций компонентов.
Для расчета значений pH в различных точках кривой титрования и ее построения необходимо вывести четыре формулы для:
1. расчета [H+] (pH) раствора слабой кислоты перед началом титрования;
2. расчета [H+] (pH) в процессе титрования в интервале 0 < τ < 100%, когда в растворе присутствует слабая кислота и ее соль, образуя буферный раствор;
3. расчета [H+] (pH) в точке эквивалентности (стехиометричности), когда в растворе находится только соль слабой кислоты и сильного основания.
4. расчета [H+] (pH) после точки эквивалентности (стехиометричности).
В соответствии с приведенной схемой рассмотрим процесс титрования раствора CH3COOH стандартным раствором NaOH.
1. Перед титрованием (τ=0) в растворе находится только слабая кислота (другими источниками ионов водорода можно пренебречь) и имеет место равновесие:
 , где
, где 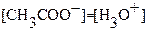
Поскольку степень диссоциации кислоты мала (<5%), то можно полагать, что равновесная концентрация недиссоциированной кислоты равна ее общей концентрации
 . Из указанных положений и константы кислотности:
. Из указанных положений и константы кислотности:
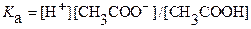 =
=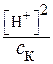 (8)
(8)
следует: 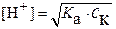 (9) и
(9) и  (10),
(10),
2. При титровании до ТЭ в области 0 < τ <100% образуется буферный раствор,
в котором сосуществуют равновесия:

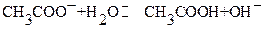
подавляющие друг друга при достаточно высоких концентрациях  и
и 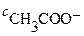 (образующейся соли). Поэтому можно считать, что
(образующейся соли). Поэтому можно считать, что  и
и  . Используя выражение для:
. Используя выражение для: 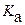 ,
,
 (11)
(11)
и, пренебрегая вкладом [Н3О+] за счет диссоциации воды, получают следующие варианты расчетных уравнений
 , (12)
, (12)
или:
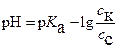 =
=  =
= 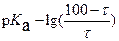
 (13),
(13),
где  исходные концентрация и объем кислоты;
исходные концентрация и объем кислоты; 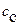 – концентрация образовавшегося сопряженного основания (соли); (
– концентрация образовавшегося сопряженного основания (соли); ( ),
),  – концентрация и объем раствора NaOH, пошедший на титрование.
– концентрация и объем раствора NaOH, пошедший на титрование.
Как видно, в этой области кривой титрования рН не зависит от разбавления объема.
3. В ТЭ растворсодержит только сопряженное основание  с ярко выраженными основными свойствами в количестве, равном исходному количеству титруемой кислоты
с ярко выраженными основными свойствами в количестве, равном исходному количеству титруемой кислоты
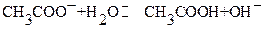 , где
, где 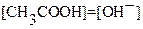 и
и 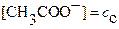
Рассматриваемому равновесию соответствует константа основности:

(14) (
Как вы помните, в водных растворах [OH–]·[H+] =  . Отсюда:
. Отсюда:
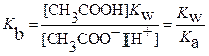 (15)
(15)
Эта важная формула справедлива для любых кислот и оснований. В результате получаем
 Þ
Þ 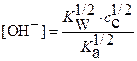 . (16)
. (16)
Откуда равновесная концентрация ионов  равна
равна
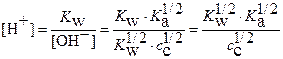 (17)
(17)
Прологарифмировав уравнение (17), и, поменяв знаки на обратные, имеем
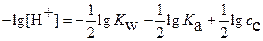 (18)
(18)
Тогда расчетное уравнение для  раствора имеет вид
раствора имеет вид
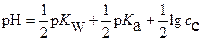 (19),
(19),
где, 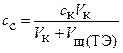
За ТЭ (τ>100%) раствор представляетсобой смесь слабого и сильного оснований. Болеесильное основание подавляет диссоциацию слабого основания. Поэтому рН раствора определяется избытком добавленного титранта и рассчитывается по одному из вариантов уравнений (6) или (7).
Расчет кривой титрования слабого основания сильной кислотой на примере титрования водного раствора аммиака хлороводородной кислотой


Перед титрованием (τ=0) в растворе находится только слабое основание (другими источниками гидроксид ионов можно пренебречь) и имеет место равновесие:
в случае водного раствора аммиака:
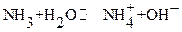 ), где
), где 
Если степень диссоциации основания мала (<5%), то можно полагать, что равновесная концентрация недиссоциированного основания равна его общей концентрации:
[ ] =
] =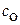 . Из указанных положений и константы основности (в случае водного раствора аммиака
. Из указанных положений и константы основности (в случае водного раствора аммиака  ) можно записать:
) можно записать:
 (20)
(20)
Отсюда 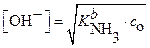 , а
, а  (21)
(21)
и 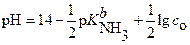 (22),
(22),
где с о ─ исходная концентрация водного раствора аммиака, а  - константа основности.
- константа основности.
При титровании до ТЭ в области 0 < τ <100% образуется буферный раствор, состоящий из смеси слабого основания и сопряженной кислоты, в котором сосуществуют равновесия:

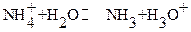
подавляющие друг друга при достаточно высоких концентрациях  и
и  (образующейся соли). Поэтому можно считать, что
(образующейся соли). Поэтому можно считать, что  и
и  . Ис-
. Ис-
пользуя выражение для 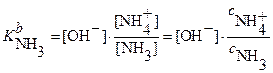 :,
:,
получают 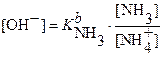 , а
, а .
.
После несложных операций получают расчетное уравнение:

откуда: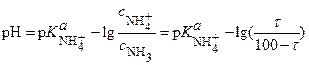 (23)
(23)
где 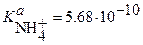 ─ константа кислотности;
─ константа кислотности;  ,
, 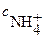 ─ молярная концентрация образовавшейся сопряженной слабой кислоты и
─ молярная концентрация образовавшейся сопряженной слабой кислоты и 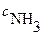 ─ молярная концентрация титруемого основания.
─ молярная концентрация титруемого основания.
В ТЭ (τ = 100%) раствор содержит только слабую сопряженную кислоту 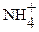 в количестве, равном исходному количеству титруемого основания.
в количестве, равном исходному количеству титруемого основания.
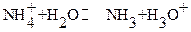 , т.е.
, т.е.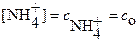 , а
, а 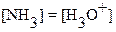 .
.
Из выражения константы кислотности:
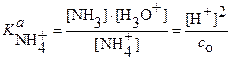
следует 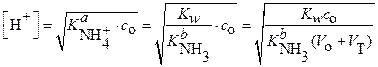
и:
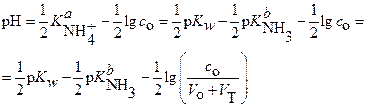 (24)
(24)
Если с о = с Т, то уравнение (24) преобразуется к виду:
 или
или 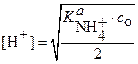
Соответственно: 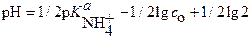 (25)
(25)
За ТЭ (τ > 100%) концентрация ионов водорода и величина рН раствора определяются избытком добавленного титранта (сильной кислоты) и расчет ведется по уравнению:
 (26)
(26)
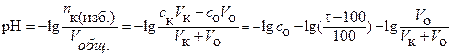 (27)
(27)
Если концентрация кислоты значительно выше концентрации основания, то множитель 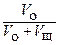 мало отличается от единицы и разбавлением раствора в процессе титрования можно пренебречь. Если при этом
мало отличается от единицы и разбавлением раствора в процессе титрования можно пренебречь. Если при этом  , то:
, то: 
Анализ кривых титрования сильных и слабых кислот и оснований показывает
(Смотри рисунки кривых титрования: Калинкин И.П., Маметнабиев Т.Э. Титриметрические методы анализа. Методические указания к лекциям по курсу учебной дисциплины «Аналитическая химия и физико – химические методы анализа».- СПб.: СПбГТИ (ТУ), 2008. – 45с. В библ № 465).
- В разных случаях ТЭ соответствует разным значениям рН, т.е. титрование приходится заканчивать при разных значениях рН. Конкретное значение рН, соответствующее ТЭ, зависит от природы реагента (титранта), титруемого вещества (аналита), а также от их концентраций.
В общем случае при титровании сильной кислоты щелочью (или наоборот) ТЭ наблюдается при рН 7.
При титровании слабой кислоты щелочью ТЭ лежит в щелочной области (при рН>7 за счет образования сопряженного основания (в рамках теории Аррениуса ─ реакции гидролиза):
(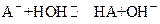 , например,
, например, 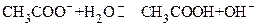 ),
),
а при титровании слабого основания сильной кислотой ТЭ лежит в кислой области при рН <7 за счет сопряженной слабой кислоты (реакции гидролиза)
(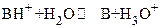 , например,
, например,  )
)
2. Величина скачка титрования зависит от концентраций титранта, титруемого вещества, температуры и от величины константы кислотности  при титровании слабой кислоты или константы основности
при титровании слабой кислоты или константы основности  при титровании слабого основания.
при титровании слабого основания.
3. Чем меньше значение  или
или  , тем меньше величина скачка титрования и тем меньше ассортимент индикаторов, которые могут быть использованы для регистрации КТТ, находящейся в пределах скачка титроваения.
, тем меньше величина скачка титрования и тем меньше ассортимент индикаторов, которые могут быть использованы для регистрации КТТ, находящейся в пределах скачка титроваения.
Кислотно - όсновные индикаторы (рН- индикаторы ). Достижение точки эквивалентности устанавливают, как правило, электрохимическими методами (потенциометрически) или с помощью кислотно‑όсновных индикаторов (pH‑индикаторов), которые изменяют свой цвет вблизи точки эквивалентности. Момент, который соответствует резкому изменению окраски индикатора является конечной точкой титрования. Чем ближе КТТ к точке эквивалентности, тем правильнее (точнее) будет результат анализа.
Разные индикаторы изменяют свой цвет при разных значениях pH. Следовательно, правильный выбор pH ‑ индикатора является одним из наиболее ответственных моментов при титровании.
По своей химической природе большинство кислотно‑основных индикаторов является сложными органическими соединениями. Молекулы
pH – индикаторов обладают слабыми кислотными или основными свойствами, причем цвет недиссоциированных молекул отличается от цвета образуемых ими ионов, то есть кислотная и основная форма имеют различную окраску. Попутно заметим, что рН ‑ индикаторы бывают одноцветные (например, фенолфталеин), двухцветные (например, метиловый оранжевый) и многоцветные. Как и для любой кислоты (или основания), для pH ‑ индикатора можно записать константу кислотности (диссоциации):
HInd + Н2О H3О+ + Ind–
H3О+ + Ind–
окраска 1 окраска 2
(кислотная форма) (основная форма)

и, через pH,
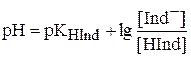
Разница в окрасках кислотной и основной форм индикатора объясняется тем, что они по‑разному поглощают свет различных длин волн. Изменение pH раствора вызывает изменения отношения концентраций кислотной и основной форм. Если интенсивность окраски обеих форм индикатора примерно одинаковы, то глаз замечает присутствие только одной формы в том случае, когда концентрация этой формы в 10 или более раз превышает концентрацию другой формы:
если  , то глаз видит цвет основной формы,
, то глаз видит цвет основной формы,
если  , то глаз видит цвет кислотной формы,
, то глаз видит цвет кислотной формы,
если  , то глаз видит переходный цвет.
, то глаз видит переходный цвет.
Интервал pH, в котором глаз воспринимает переходный цвет, называют интервалом перехода окраски индикатора или просто интервалом перехода индикатора. Подставляя крайние значении отношения  в вышеприведенное уравнение
в вышеприведенное уравнение
получим 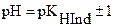
(при условии одинаковой интенсивности окраски обеих форм индикатора).
Середина области перехода окраски индикатора (при этом рН = 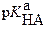 ) называется показателем титрования (показателем индикатора) (рТ), который фактически соответствует рН в КТТ.
) называется показателем титрования (показателем индикатора) (рТ), который фактически соответствует рН в КТТ.
pH‑индикаторы должны удовлетворять следующим требованиям:
1. Окраска индикатора должна быть возможно более интенсивной;
2. Изменение окраски должно происходить резко в небольшом интервале значений pH;
3. Количество щелочи или кислоты, необходимое для изменения окраски индикатора, должно быть настолько мало, чтобы не искажались результаты титрования;
4. Изменение окраски индикатора должно быть быстро обратимым процессом.
Характеристики pH ‑ индикаторов приводятся в справочных таблицах, подобных представленной ниже:
| индикатор | окраска формы | интервал изменения цвета | pKHInd | pT | |
| кислотной | основной | ||||
| Метиловый оранжевый | красная | желтая | 3.1–4.4 | 4.2 | 4.0 |
| фенолфталеин | бесцветная | малиновая | 8.0–9.8 | 9.7 | 9.0 |
| метилрот | красная | желтая | 4.4–6.2 | 5.0 | 5.5 |
| лакмус | красная | синяя | 5.0–8.0 | 7.0 |
Правильный выбор индикатора зависит от типа кривой титрования, величины скачка (кривой) титрования и от природы и свойств самого индикатора. Необходимо придерживаться следующих основных правил:
1. Предпочтение следует отдать индикатору, у которого значение pT максимально близко к pH в точке эквивалентности;
2. Интервал перехода окраски pH ‑индикатора должен полностью или большей частью входить в пределы скачка (кривой) титрования. Индикаторы с растянутым интервалом перехода окраски (лакмус) для титрования не пригодны;
3. При титровании слабых кислот нельзя применять индикаторы с интервалом перехода, который находится в кислой области (например, метиловый оранжевый);
4. При титровании слабых оснований нельзя применять индикаторы с интервалом перехода, который находится в щелочной области (например, фенолфталеин).
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 905; Нарушение авторских прав?; Мы поможем в написании вашей работы!