
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Эволюция представлений о строении атома
|
|
|
|
Строение атома
Лекция 2
Представления о сложности строения атома возникли в последней четверти XIX в. Эти представления были подтверждены рядом открытий конца XIX начала XX века.
1) Выделение из атомов отрицательно заряженных частиц – электронов (1897 г. Дж.Томсон).
Опыты:
а) отклонение катодного излучения (пучка отрицательно заряженных частиц) в электрическом поле в сторону положительного полюса;
б) испускание электронов поверхностью металлов при накаливании или освещении УФ излучением.
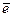 - электрон:
- электрон:
абсолютный заряд -1,6 . 10-19 Кл
относительный заряд -1
масса 9,1 . 10-31 кг
5,486 . 10-4 а.е.м.
(1 а.е.м. = 1,66 . 10-27 кг, т.е. 1/12 массы атома изотопа углерода 12, 12С)
2) Открытие явления радиоактивности – подтвердило наличие в атоме положительно заряженных частиц – протонов.
(А. Беккерель,1886 г. наблюдал действие соединений урана на фотографическую пластинку, завернутую в черную бумагу).
Пьер и Мария Кюри, 1848 г. – исследовали радиоактивное излучение. В электрическом и магнитном поле оно распределяется на 3 потока:
α–частицы – положительно заряженные;
β–излучение – поток электронов (отклоняется к положительному полюсу);
γ-излучение – не отклоняется в электромагнитном поле, это рентгеновские лучи (открыты Рентгеном,1895 г.)
3) Создание ядерной модели атома. Составная часть атома – ядро (открыто в 1911 г. Э.Резерфордом). Он исследовал прохождение α–частиц через вещество (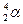 –частицы – ядра атома
–частицы – ядра атома 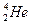 , образуются при радиоактивном распаде
, образуются при радиоактивном распаде
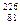 Ra ->
Ra -> 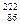 Rn +
Rn + 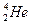
Наблюдения:
1. Отклонение α-частиц при прохождении через тонкую металлическую пластинку (указывает на наличие массивных положительно заряженных частиц с очень малым объемом)
2. Искусственная ядерная реакция (1919 г. Э. Резерфорд: выделение ядер – протонов)
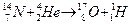
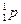 - протон: абсолютный заряд +1,6 .10-19 кл
- протон: абсолютный заряд +1,6 .10-19 кл
относительный заряд +1
масса 1,67 .10-27 кг
1,0073 а.е.м.
Ядерная (планетарная) модель по Резерфорду:
в центре атома – ядро, положительно заряженное, вокруг которого вращаются электроны, отрицательно заряженные.
Атом – электронейтрален, заряд ядра равен суммарному отрицательному заряду электронов.
Средний размер атома: 10-10 м, ядра: 10-15 – 10-14 м, плотность вещества в ядре в 1015 раз выше, чем в атоме.
4) Создание теории состава ядра (теория состава атомных ядер Д.Д.Иваненко, Е.Н. Гапона -1932 г.; В.Гейзенберга - протонно-нейтронная теория)
Теория создана вслед за открытием элементарной частицы нейтрона (Дж.Чедвик, 1932 г.)
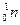 - нейтрон: заряд 0
- нейтрон: заряд 0
масса 1,67 .10-27 кг
1,0087 а.е.м
Согласно протонно-нейтронной теории (ПНТ):
1. Ядра атомов (кроме водорода) состоят из протонов и нейтронов;
2. Число протонов в ядре равно положительному заряду ядра (порядковый или атомный номер элемента в Периодической системе);
3. Сумма числа протонов и нейтронов (нуклонов) равна массовому числу атома (округленной до целого числа относительной атомной массе)
А = N + Z
4. Изотопы (с точки зрения ПНТ) – разновидность элементов, ядра атомов которых содержат различное число нейтронов, но одинаковое число протонов (поэтому обладают различными массовыми числами).
ПНТ объяснила противоречие - почему атомные массы не целые числа. Понятия «относительная атомная масса» и «массовое число изотопа» различаются.
Относительная атомная масса элемента представляет собой среднее значение массовых чисел всех природных изотопов с учетом их распространенности.
Пример: 
В природе хлор состоит из двух изотопов 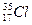 - 75,4 % и
- 75,4 % и 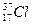 - 24,6%
- 24,6%
Относительная атомная масса Cl: 35,453.
Поэтому главная характеристика элемента: заряд ядра, а не атомная масса.
5) Электронные оболочки атомов.
Недостаток планетарной модели Резерфорда: противоречие классической электродинамике – в результате ускоренного движения 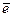 расходуется энергия его электростатического взаимодействия с ядром, в результате чего он должен упасть на ядро через 10-8 с.
расходуется энергия его электростатического взаимодействия с ядром, в результате чего он должен упасть на ядро через 10-8 с.
На самом деле атомы устойчивы. Это противоречие частично разрешил Н.Бор, разработавший в 1913 г.теорию водородного атома на основе:
1. Классической механики;
2. Квантовой теории Планка(1900), учения Эйнштейна (1908) о световых квантах.
3. Модели Резерфорда
Постулаты Бора
1. Существует ряд статических состояний 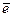 , в которых его притяжение к ядру уравновешивается центробежной силой, оставаясь в этих состояниях сколь угодно долго, не теряя энергии.
, в которых его притяжение к ядру уравновешивается центробежной силой, оставаясь в этих состояниях сколь угодно долго, не теряя энергии.
Значение радиуса орбиты (Боровский радиус)
r = 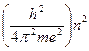 , где n = 1,2,…..,
, где n = 1,2,…..,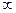
n –главное квантовое число, характеризует номер энергетическоо уровня атома.
h – постоянная Планка, 6,626 . 10-34 Дж . с
m – масса атома;
e – заряд электрона.
2. При переходе электрона с одного уровня на другой излучается энергия. Это объясняет происхождение атомных спектров.
ЕВ – ЕН = hν,
где ν - частота электромагнитного излучения.
Недостатки теории Бора:
1. Возможность применения только к атому водорода; непригодность для объяснения более сложных атомов
2. Представления об электроне упрощены; он рассматривается как просто заряженная частица, подчиняющаяся тем же законам, что и макроскопические заряженные тела.
6) Квантово-механическая модель строения атома
В 1924 г. французский химик Луи де Бройль высказал идею, что материя обладает как волновыми, так и корпускулярными свойствами:
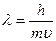 ,
,
где 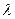 - длина волны, m – масса частицы,
- длина волны, m – масса частицы, 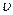 - скорость движения частицы.
- скорость движения частицы.
В 1927 г. немецкий ученый В.Гейзенберг предложил принцип неопределенности - для микрочастиц невозможно одновременно точно определить т координату Х и импульс Р вдоль оси Х:
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 1855; Нарушение авторских прав?; Мы поможем в написании вашей работы!