
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение состояния
|
|
|
|
Связь между параметрами p, v, T называется термическим уравнением состояния
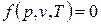
|
или
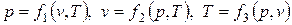 . .
|
Эти уравнения показывают, что из трех параметров, определяющих состояние системы, независимыми являются два.
Конкретный вид уравнения состояния зависит от свойств веществ.
Для идеального газа термическое уравнение состояния имеет вид:
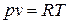 , ,
| (1.3) |
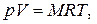
| (1.4) |
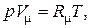
| (1.5) |
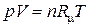 . .
| (1.6) |
В уравнениях (1.3) – (1.6) используются следующие обозначения: p – абсолютное давление, Па; v – удельный объем, м3/кг; T – абсолютная температура, К; M – масса газа, кг; V – объем газа, м3; 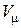 – объем 1 киломоля газа, м3/кмоль;
– объем 1 киломоля газа, м3/кмоль; 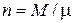 – число киломолей газа;
– число киломолей газа; 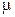 – мольная масса газа, кг/кмоль;
– мольная масса газа, кг/кмоль;
R m = 8314 Дж/(кмоль×К) – универсальная газовая постоянная; 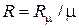 – газовая постоянная, Дж/(кг×К).
– газовая постоянная, Дж/(кг×К).
В реальных газах, в отличие от идеальных, существенны силы межмолекулярных взаимодействий, и нельзя пренебречь собственным объемом молекул. Термическое уравнение состояния реального газа можно представить
в виде
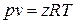 , ,
| (1.7) |
где 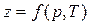 – коэффициент сжимаемости.
– коэффициент сжимаемости.
Вся сложность расчетов по уравнению (1.7) состоит в определении коэффициента сжимаемости. Реальные газы при T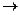 ¥ или
¥ или 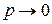 становятся идеальными, при этом z = 1.
становятся идеальными, при этом z = 1.
Понятие идеального газа является научной абстракцией, моделью реального газа, дающей хорошую сходимость с практикой. Для состояний газа, близких к состоянию сжижения (насыщенного пара) модель идеального газа неприемлема.
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 255; Нарушение авторских прав?; Мы поможем в написании вашей работы!