
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Адиабатный процесс
|
|
|
|
Адиабатным называется процесс, который протекает без теплообмена с окружающей средой (dq = 0).
В обратимых адиабатных процессах энтропия не изменяется (ds = 0,
s = const), в необратимых – энтропия увеличивается (ds > 0).
Уравнение обратимого адиабатного процесса имеет вид
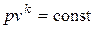 , ,
| (4.43) |
где k – показатель адиабаты.
Для идеального газа
 . .
| (4.44) |
Для одноатомного идеального газа показатель адиабаты не зависит от температуры:
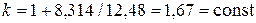 . .
|
Для двух-, трех- и многоатомных идеальных газов k = f (T), т. к. теплоемкость m cv = f (T). С увеличением температуры показатель адиабаты убывает.
Если принять теплоемкость постоянной в соответствии с молекулярно-кинетической теорией газов, то для двухатомных газов
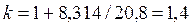 , ,
|
для трех- и многоатомных газов:
 . .
|
Расчет адиабатных процессов двух-, трех- и многоатомных газов при значениях показателя адиабаты 1,4; 1,29 является приближенным, т. к. не учитывает зависимость теплоемкости от температуры.
Совместное решение (4.43) с уравнением состояния идеального газа
pv = RT дает следующие связи параметров:
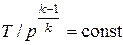 , ,
| (4.45) |
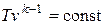 . .
| (4.46) |
Для адиабатного процесса 1-2, в котором параметры изменяются от p 1, v 1, T 1 до p 2, v 2, T 2, на основании уравнений (4.43), (4.45), (4.46) можно получить следующие соотношения между параметрами:
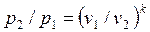 , ,
| (4.47) |
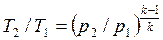 , ,
| (4.48) |
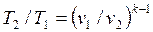 . .
| (4.49) |
Совместное решение уравнений
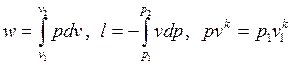
позволяет получить расчетные формулы для работы адиабатного процесса 1-2:
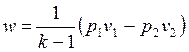 , ,
| (4.50) |
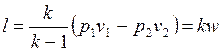 . .
| (4.51) |
С учетом уравнения состояния pv = RT, а также соотношения (4.48) формулу (4.50) можно представить следующим образом:
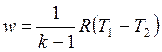 , ,
| (4.52) |
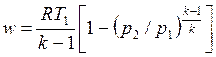 . .
| (4.53) |
По формулам (4.46) – (4.53) производят расчеты адиабатных процессов одноатомного идеального газа и приближенные расчеты двух-, трех- и многоатомных газов при значениях k = 1,4; k = 1,29.
Расчет адиабатных процессов с учетом зависимости k = f (T) по вышеприведенным формулам прост, если известны температуры T 1 и T 2. В противном случае используется метод последовательных приближений, что значительно усложняет расчет.
Более простым является табличный метод расчета адиабатного процесса идеального газа с учетом зависимости теплоемкости от температуры. В основе расчета лежат следующие уравнения:
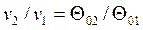 , ,
| (4.54) |
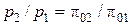 , ,
| (4.55) |
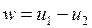 , ,
| (4.56) |
 . .
| (4.57) |
Здесь 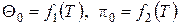 – безразмерные величины, приведенные в таблицах термодинамических свойств газов [7]; h, u – табличные значения параметров.
– безразмерные величины, приведенные в таблицах термодинамических свойств газов [7]; h, u – табличные значения параметров.
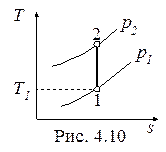
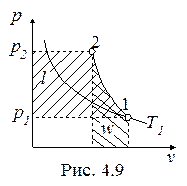 |
Обратимый адиабатный процесссжатия идеального газа, построенный по исходным параметрам p 1, T 1, p 2 в p - v- и T - s- диаграммах, представлен на рис.4.9 и 4.10.
В p - v- диаграмме адиабата – несимметричная гипербола располагается круче изотермы, в T - s- диаграмме – изоэнтропа (s = const, q = 0).
 | 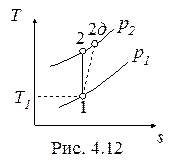 | ||
Необратимые адиабатные процессы (1-2 д), протекающие с увеличением энтропии, показаны на рис. 4.11, 4.12.
Работа необратимого адиабатного расширения (см. рис. 4.11) равна
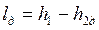 , ,
|
и она меньше работы обратимого процесса, вычисляемого по формуле
 . .
|
Напротив, работа необратимого адиабатного сжатия (см. рис. 4.12), равная
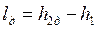 , ,
|
больше работы обратимого процесса
 . .
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 593; Нарушение авторских прав?; Мы поможем в написании вашей работы!