
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Двухатомные молекулы
|
|
|
|
Схема энергетических уровней
Рентгеновские спектры тяжелых элементов не зависят от того, в состав каких химических соединений они входят. Это означает, что силы удерживающие атомы в молекуле обусловлены взаимодействием внешних электронов.
В двухатомных молекулах существует 2 типа связей:
1. Гетерополярная (ионная). Электроны в молекуле можно разделить на 2 группы, каждая из которых все время находится возле одного из ядер (Na+Cl–, H+Cl–). Электроны распределяются так, что около одного из ядер образуется избыток электронов, а около другого – их недостаток.
2. Атомная (гомеополярная). Образуется парами электронов с противоположно направленными спинами и осуществляется при обобществлении валентных электронов двумя соседними атомами (H2, С2, СО). Неразличимость частиц приводит к специфическому взаимодействию между ними, называемому обменным. Это чисто квантовый эффект, который проявляется в том, что электрон каждого из атомов проводит некоторое время у ядра другого атома. Таким образом, осуществляется связь обоих атомов, образующих молекулу.
Молекула является квантовой системой и описывается уравнением Шредингера. В 1927 г. Гайтлер и Лондон решили данную задачу для основного состояния молекулы водорода.
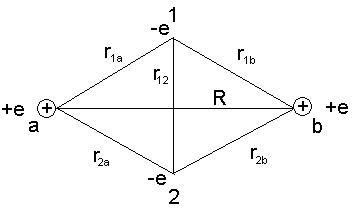
Потенциальная энергия такой системы, состоящей из двух протонов и двух электронов, равна
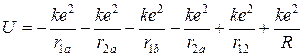 . (10.2)
. (10.2)
В адиабатическом приближении уравнение Шредингера примет вид:
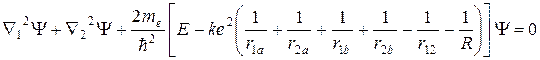 (10.3)
(10.3)
Здесь 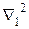 зависит только от координат первого электрона, а
зависит только от координат первого электрона, а 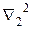 - от координат второго электрона. Собственные значения энергии определяются расстоянием между ядрами R, причем в случаях параллельной и антипараллельной ориентации спинов характер этой зависимости существенно различен (рис). Образование молекулы возможно только при антипараллельных спинах.
- от координат второго электрона. Собственные значения энергии определяются расстоянием между ядрами R, причем в случаях параллельной и антипараллельной ориентации спинов характер этой зависимости существенно различен (рис). Образование молекулы возможно только при антипараллельных спинах.
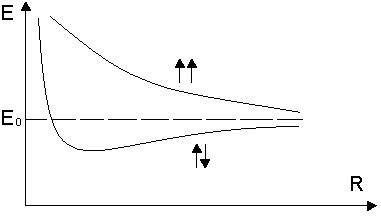
Аналогично дело обстоит и для других двухатомных молекул. Энергия, обусловленная электронной конфигурацией, имеет минимум при некотором значении R.
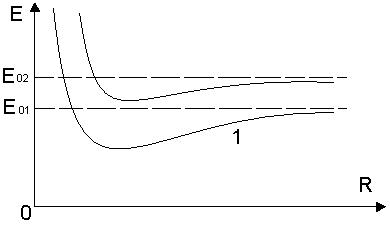
При заданной электронной конфигурации ядра молекулы могут различным образом колебаться и вращаться относительно общего центра инерции.
Энергия изолированной молекулы
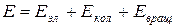 (10.4)
(10.4)
где 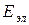 – энергия движения электронов относительно ядер (электронная энергия);
– энергия движения электронов относительно ядер (электронная энергия); 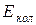 – энергия, обусловленная колебанием ядер (колебательная или вибрационная энергия);
– энергия, обусловленная колебанием ядер (колебательная или вибрационная энергия); 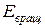 – энергия вращательного движения молекулы (вращательная или ротационная энергия).
– энергия вращательного движения молекулы (вращательная или ротационная энергия).
Энергия гармонического осциллятора определяется выражением:
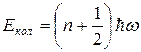 (
(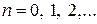 ), (10.5)
), (10.5)
где правило отбора 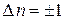 и уровни энергии являются эквидистантными.
и уровни энергии являются эквидистантными.
Если колебания велики, то эквидистантность нарушается и, с увеличением колебательного квантового числа n, уровни сгущаются.
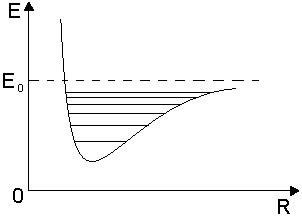
Из классической физики вращательная энергия
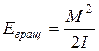 , где
, где 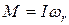 – момент импульса системы, I – момент инерции молекулы.
– момент импульса системы, I – момент инерции молекулы.
Момент импульса в квантовой механике:
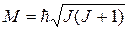 , где
, где 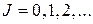 – вращательное квантовое число, для которого выполняется правило отбора
– вращательное квантовое число, для которого выполняется правило отбора 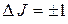 . Тогда
. Тогда
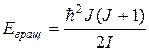 . (10.6)
. (10.6)
С учетом этого полная энергия молекулы примет вид
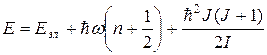 . (10.7)
. (10.7)
Опыт и теория показывают, что расстояние между вращательными уровнями 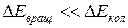 , в свою очередь,
, в свою очередь, 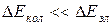 . Поэтому схема уровней такова:
. Поэтому схема уровней такова:

Если атомные спектры состоят из линий, то молекулярные имеют вид полос, которые представляют собой большое число тесно расположенных линий.
Частоты спектральных линий, испускаемых молекулами, могут соответствовать переходам с одного электронного уровня на другой или с одного колебательного (вращательного) уровня на другой. Кроме того, возможны и переходы с одними значениями 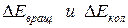 на уровни, имеющие другие значения всех трех компонентов, в результате чего возникают электронно-колебательные и колебательно-вращательные спектры.
на уровни, имеющие другие значения всех трех компонентов, в результате чего возникают электронно-колебательные и колебательно-вращательные спектры.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 1586; Нарушение авторских прав?; Мы поможем в написании вашей работы!