
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
N Нормальные электродные потенциалы
|
|
|
|
N Между атомами водорода на платине и ионами водорода в растворе устанавливается равновесие.
n 0,5 Н2 D Н+ + ē
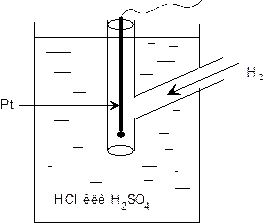
n В качестве нормального водородного электрода принимается водородный электрод, работающий
n 1/ t = 298,15 К;
n 2/ давление 1 атм [1,01325·105 Па];
n 3/ концентрация или активность С Н+ = 1 г-ион/л; а Н+ = 1 моль/л.
n потенциал его равен нулю. е = 0:
n Нормальный водородный электрод используется для сравнения с электродами, имеющими неизвестный потенциал, поэтому его называют электродом сравнения.
n Нормальный электродный потенциал — этот потенциал, возникающий на металлической пластинке, погружённой в раствор соли этого же металла, с активностью ионов данного металла, равной 1 моль/л при сравнении с потенциалом нормального водородного электрода.
n Хлорсеребряный электрод –эл-дсравнения
n Ag/ AgCl/ KClнасыщ
n состоит из серебряной проволоки, покрытой твёрдой солью AgCl и погружённой в раствор KCl.
n КCl D К+ + Сl-
n Ag D Ag+ + ē
n Ag+ + Cl– ® AgCl¯
n Потенциал электрода, зависит обратно пропорционально от концентрации ионов хлора в растворе т.е. от концентрации KCl
n При 25°С в насыщенном растворе KCl потенциал хлорсеребряного электрода +245,8 мВ.
n Эл-ды определения рН:
¡ 1. водородный
n Р= 1атм
n Сн+ - переменная величина
n ев= 0+ 0,058/1 lg [H+]
n pH=-lg [H+]
n eв=-0, 058 pH
n 2. стеклянный
n Стеклянный электрод - тонкостенный стеклянный шарик, заполненный раствором с определённым значением рН [например, 0,1 н раствором HCl], в котором помещён внутренний контактный электрод, чаще всего хлорсеребряный.
n Стеклянный электрод помещают в исследуемый раствор и соединяют при помощи электролитического мостика с электродом сравнения — внешним хлорсеребряным
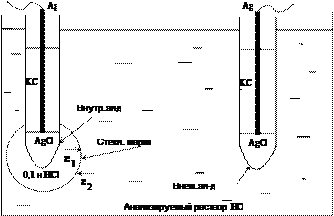 |
• Применение стеклянного электрода основано на том,
• что стекло содержит катионы, которые могут обмениваться с катионами, находящимися в растворе:
• Na+(стекло) + Н+ (р-р) = Н+ (ст.) +Na+ (р-р)
• По обе стороны стеклянной мембраны возникают потенциалы Е1 и Е2, зависящие от активности обоих растворов HCl.
• Ag/ AgCl/ KClнасыщ/ Н+ внутри/Н+ снаружи
• 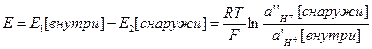
• 1. Стеклянный электрод не обменивает электроны, только ионы водорода.
• 2. Потенциал стеклянного электрода очень мал, его можно измерить только в специальных приборах — рН-метрах, где он усиливается.
• 3. он позволяет определить [от 0 до 14].
• 4. недостатки: хрупкость, отравляется As и Hg.
l При соприкосновении растворов разных концентраций растворённое вещество диффундирует в раствор с меньшей концентрацией.
l Если диффундирующие ионы имеют разную скорость, то более подвижные ионы оказываются впереди.
l На границе раздела растворов возникает так называемый диффузионный потенциал, который усредняет скорости движения ионов.
l Диффузионные потенциалы могут возникать при повреждении поверхностного слоя клеток. При этом нарушается избирательность их проницаемости. Возникает потенциал повреждения= 30-40 мВ.
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 802; Нарушение авторских прав?; Мы поможем в написании вашей работы!