
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физико-химические основы процесса горения
|
|
|
|
ГОРЕНИЕ ОРГАНИЧЕСКОГО ТОПЛИВА
Горением называется быстрый процесс экзотермического окисления горючего вещества, сопровождающийся выделением значительного количества тепловой энергии. Основой процесса горения является химическая реакция между окисляемым горючим веществом и окислителем— веществом, содержащим кислород или активные его соединения, с образованием его окислов. Горючим веществом могут быть: органическое топливо, некоторые металлы, углеводородные соединения и др.; окислителем — кислород, воздух (смесь 79 % азота и 21% кислорода), перекись водорода Н2О2, некоторые кислоты, например НNOз, и др. Для того чтобы процесс горения произошел, необходимо наличие горючего и окислителя, контакт между ними на молекулярном уровне, тепловые условия, достаточные для протекания химической реакции с высокими скоростями. Таким образом, процесс горения— это многофакторный, сложный физико-химический процесс взаимодействия химических, тепловых и гидродинамических факторов.
Особенностями процесса горения, отличающими его от родственных процессов окисления, являются: 1) высокая температура; 2) быстротечность во времени; 3) как правило, неизотермичность и переменность концентраций компонентов по мере их взаимодействия; 4) изменение структуры и формы поверхности реагирования во времени. По своей природе горение — процесс, протекающий всегда при непрерывном подводе горючего и окислителя в зону горения и отводе газообразных продуктов сгорания из нее. В связи сэтим независимо от технологии сжигания топлива закономерности горения горючего всреде окислителя являются объективно неизменными, определяющимися только начальными и граничными условиями его протекания.
Воснове процесса горения лежат химические реакции горючего с окислителем. Применительно к углеводородным горючим, которыми являются все виды органического топлива, чистый углерод и водород, целесообразно выделить следующие химические реакции, протекающие с выделением или поглощением теплоты, в КДж/моль:
а) первичные экзотермические химические реакции полного горения:

Реакции (2.8) и (2.9) являются экзотермическими, а (2.10)—эндотермической. Принципиальной особенностью всех реакций горения является их обратимость; ни одна из этих реакций не идет до конца, а лишь до состояния химического равновесия, при котором имеют место все компоненты реакции. Состояние химического равновесия зависит от температуры, давления и соотношения концентраций реагирующих веществ.
Направление изменения равновесия реакций под действием внешних факторов определяется принципом Ле-Шателье, согласно которому: если на систему, находящуюся в химическом равновесии, воздействовать извне, то в ней возникнут самопроизвольные процессы, стремящиеся ослабить это воздействие. Применительно к реакциям горения такими возможными факторами, влияющими на химическое равновесие реакций, являются: тепловыделение, сопровождающееся повышением температуры; возможное изменение давления и изменение концентрации какого-либо компонента реакции. Так, повышение температуры сопровождается торможением реакций, протекающих с большим тепловыделением, например, из реакций, описываемых уравнениями (2.1) и (2.5) преимущественное развитие приобретает реакция по уравнению (2.5). При очень высоких температурах (свыше 1600— 1800 °С) углерод топлива первично реагирует с кислородом в большей степени с образованием СО, а не СО2, как это имеет место при низких температурах (1000—1300°С). Повышение давления тормозит реакции, протекающие с увеличением объема, например реакции (2.4), (2.7), (2.10), и др. Если из системы, как это имеет место в топочных процессах, продукт реакции выводится и концентрация его снижается, то химическое реагирование стремится компенсировать это понижение концентрации, способствуя тем самым более полному протеканию реакций горения.
Кинетические основы процесса горения. В общем виде обратимая химическая реакция может быть записана стехиометрическим уравнением
vA1 А1 + vA2 А2 +... = vB1 B1 + vB2,В2 (2.11)
где А1, А2 и B1, B2 — химические символы реагирующих веществ; vai, Va2 и Vbi, Vb2 — стехиометрические коэффициенты.
Зависимость скорости реакции от концентрации реагирующих веществ определяется законом действия масс: в однородной среде при постоянной температуре скорость реакции пропорциональна произведению концентраций реагирующих веществ. Для реакции (2.11) скорость прямой реакции в соответствии с законом действия масс может быть записана
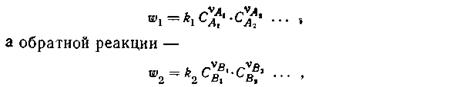
где Са\, Са2, Св1 Св2, … — текущие концентрации реагирующих веществ; k1 и k2 — константы скорости прямой и обратной реакции (коэффициенты пропорциональности, зависящие от температуры и химической природы реагирующих веществ).
При химическом равновесии скорости прямой и обратной реакций уравниваются:

где kc — константа равновесия, также являющаяся постоянной величиной, характеризующая только возможность глубины протекания химической реакции при заданных давлении р и температуре Т.
Акты химического превращения исходных веществ в конечные продукты в результате реакции происходят вследствие соударения молекул, т. е. при их сближении, когда достаточно активно проявляется влияние сил отталкивания. При этом нормальная составляющая кинетической энергии соударяющихся молекул переходит в потенциальную и может быть затрачена на разрушение первоначальных связей в молекуле. Это произойдет, если образовавшаяся потенциальная энергия будет выше некоторого уровня, необходимого для разрушения первоначальных связей в молекуле. Такой уровень называется энергией активации Е.
Для того чтобы реакция между молекулами А и В произошла, необходимо:
(mV2)/2>E; m = (тА тв)/(тА + тв).
где т — приведенная масса соударяющихся молекул; mа и тв массы молекул А и В;V — нормальная составляющая относительной скорости молекул.
Но не всякие столкновения молекул, при которых энергия столкновения превышает энергию активации Е, приведут к химической реакции; необходимо, чтобы соударяющиеся молекулы были должным образом соориентированы между собой так, чтобы удар одной молекулы о другую был в наиболее слабом участке ее структуры. В итоге скорость реакции, выраженную числом актов химического превращения в единице объема за единицу времени (закон Аррениуса), можно записать
w = koe-E/(RT)nAnB
где ka — коэффициент, пропорциональный доле активных столкновений молекул, приводящих к химической реакции, который называется предэкспоненциальным множителем; R — универсальная газовая постоянная; пА и пв — концентрации молекул веществ А и В в объеме; к0еЕ/(RT) — константа скорости реакции, так как k0, слабо зависит от температуры по сравнению с экспонентой, в расчетах полагают k0= const.
Применительно к ранее рассматриваемой реакции (2.11) скорость в соответствии с законом действия масс и законом Аррениуса может быть записана в виде
w = koe-E/(RT)CvA1A! CvA2A2
Для сложных реакций характерным является ход реакции через промежуточные этапы, в которых часто активными участками становятся активные центры — отдельные атомы, радикалы, молекулы. При сложной реакции выражение для ее скорости можно записать аналогично уравнению (2.12), однако в этом случае величины k0 и Е определяют на основании обработки опытных данных, а показатели степени vai и va2 подбирают таким образом, чтобы удовлетворить результатам эксперимента. В этом случае сумма показателей степени при концентрациях называется порядком реакции и выражает зависимость скорости реакции от давления; константу скорости такой реакции, удовлетворяющей закону Аррениуса, называют кажущейся или видимой. Размерность константы скорости реакции k зависит от порядка реакции; для реакций первого порядка (vai+va2+... = 1,0) ее размерность есть обратная величина времени (1/с); для реакции второго порядка (vai + +va2+". = 2,0) она равна м3/(моль·с).
В элементарной обратимой реакции энергии активации прямой (E1) и обратной (Е2) реакций можно рассматривать как некоторый потенциальный барьер, который надо преодолеть для ее совершения и перехода на новый энергетический уровень. Если прямая реакция экзотермична, то выделяется теплота реакции QP; для обратной реакции нужно преодолеть больший энергетический барьер Е2, и теплота реакции будет потребляться. Реакции горения органических топлив относятся к сложным реакциям, протекающим через активные центры, со значениями энергии активации Е от 42— 84 до 167—209 кДж/моль. Большой разброс значений энергии активации определяется большим разнообразием структуры и активности молекул органических веществ, используемых в качестве топлива.
Важной отличительной особенностью реакций горения является цепной механизм их протекания, характеризующийся тем, что реакция протекает не непосредственно между молекулами исходных веществ, а через промежуточные стадии, что позволяет обойти большой энергетический барьер, который потребовалось бы преодолеть для осуществления прямой реакции между исходными компонентами. В цепных реакциях различают: зарождение цепей — образование активного продукта, разветвление цепей — увеличение концентрации активного продукта в результате реакций с исходным веществом, обрыв цепей — процесс, при котором молекула активного продукта уничтожается. Реакция, при которой концентрация активного промежуточного продукта остается постоянной и равной равновесному его значению, называется неразветвленной цепной реакцией. Если в процессе реакции происходит увеличение активного промежуточного продукта, то суммарная скорость реакции непрерывно возрастает и наступает ее нестационарное протекание. Такая реакция называется разветвленной цепной реакцией. Характерным примером разветвленной реакции является окисление водорода
2Н2 + 02->-2Н20.
Реакция СО+02->2С02 протекает через промежуточные реакции с активными центрами Н и ОН, образующимися при наличии в среде небольших количеств Н20 или Н2. Реакцией продолжения цепи с одновременным получением конечного продукта является СО+ОН->С02+Н. Горение газообразных углеводородов также протекает по цепному механизму; активными центрами в них служат атомарные водород и кислород,
Тепловой поток от объема реагирующей смеси в окружающую среду, отнесенный к единице объема, принят в виде линейной функции относительно температуры
Qt = aF/V(T — T0),
гдеа — коэффициент теплоотдачи, Вт/(м2-К); F и V — поверхность и объем сосуда, в котором находится горючая смесь, соответственно, м2 и м3; Т и То — температуры реагирующей смеси и стенок сосуда, К.
Диффузия и массообмен в процессе горения. Процесс горения будет стационарным, если кроме химической реакции и тепловых условий, обеспечивающих достаточную скорость ее протекания, вернее параллельно с химической реакцией, будет обеспечен непрерывный подвод горючего и окислителя в зону реакции и соответственно отвод продуктов сгорания из нее. Для протекания реакции необходимо перемешивание компонентов на молекулярном уровне, иными словами, необходим процесс массопереноса реагирующих компонентов в зону реакции и продуктов реакции из нее. Процесс массопереноса осуществляется в турбулентном потоке за счет турбулентной диффузии, а в неподвижной среде, ламинарном потоке и в пограничном слое потока — за счет молекулярной диффузии. Молекулярная диффузия при постоянных температуре и давлении происходит за счет градиента концентрации компонента и описывается законом Фика (аналогично закону Фурье для теплопроводности):

где gi — массовый поток компонента /, кг/(см2-С); D 12 — коэффициент молекулярной диффузии компонентов 1 и 2, см2/с; dCdx — градиент концентрации Си компонента 1 в направлении х, кг/см4.
Коэффициент диффузии D12 является функцией температуры и давления:

Коэффициент п может меняться от 2,5 (для низких температур) до 1,5 (для высоких температур). Для реакций горения при температурах до 1200—1500 К принимают л=2,0, а при более высоких — «=1,5. Значения коэффициента взаимной диффузии D0i2> см2/с, при нормальных условиях (р0 = 101,3 кПа; Т0=273 К) получены экспериментально для компонентов: кислород — азот — 0,181—0,187; кислород — воздух—0,178; кислород — Двуокись углерода —0,139; двуокись углерода — воздух— 0.138; двуокись углерода — азот—0,15; водяной пар — воздух—0,22; окись углерода — азот—0,192.
При неизотермических условиях диффузионный поток вещества зависит не только от градиента концентрации, Но и от градиента температуры. Термодиффузия (т. е. диффузия вещества, вызванная градиентом температур) обычно мала и имеет значение в расчетах только при горении водорода и его смесей.
В зависимости от фазового состояния реагирующих веществ при горении (твердое, жидкое, газообразное) химические реакции делят на: гомогенные, протекающие в объеме между компонентами, находящимися в одной, как правило, газообразной фазе, и гетерогенные, протекающие на поверхности раздела фаз — твердой, жидкой и газообразной. В соответствии с этими названиями реакций горение топлив также условно делят на гомогенное и гетерогенное горение. Примерами гомогенного горения являются: горение хорошо перемешанных газообразных компонентов, горение быстро испаряющихся жидких топлив в случае, когда перемешивание образовавшихся паров топлива с окислителем предшествует процессу горения. Примерами гетерогенного горения на поверхности раздела фаз могут служить: горение твердых топлив, горение капель тяжелых жидких топлив в случае, если фронт горения устанавливается на границе раздела паров топлива и окислителя, и др. В зависимости от характера реакций анализ процесса горения проводят в соответствии с разработанными моделями теорий гомогенного и гетерогенного горения.
Любой процесс горения топлив по своей сути является поточным процессом, поскольку для его протекания необходимы непрерывный подвод компонентов в зону реакции и отвод из нее продуктов сгорания. Подвод компонентов в зону реакции производится за счет диффузии молекул горючего и окислителя. При горении топлива в потоке газообразного окисления независимо от характера реакций (гомогенной или гетерогенной) возможна организация протекания процесса в ламинарном и турбулентном потоке, что существенно сказывается на закономерностях развития процесса. В связи с этим процесс горения подразделяют на ламинарное горение (т. е. горение в ламинарном потоке окислителя) и турбулентное горение (горение в турбулентном потоке окислителя).
ГОРЕНИЕ ТВЕРДОГО ТОПЛИВА
Твердое топливо является термически нестойким органическим веществом, процесс горения которого протекает через ряд стадий. Основной стадией, определяющей интенсивность всего процесса в целом, является стадия горения так называемого коксового остатка — углерода, оставшегося в частице топлива после завершения деструкции вещества исходного топлива и выхода летучих веществ. В основе процесса горения частиц углерода лежат гетерогенные химические реакции взаимодействия углерода с окружающими горящую частицу газами: 02, Н20, С02 и др.
В основе процесса горения частицы углерода, движущейся в потоке воздуха, лежит модель, согласно которой угольные частицы малых размеров приобретают скорость, близкую к скоростям движения потока воздуха. При таком условии вынужденный конвективный перенос массы отсутствует и частица выгорает равномерно.
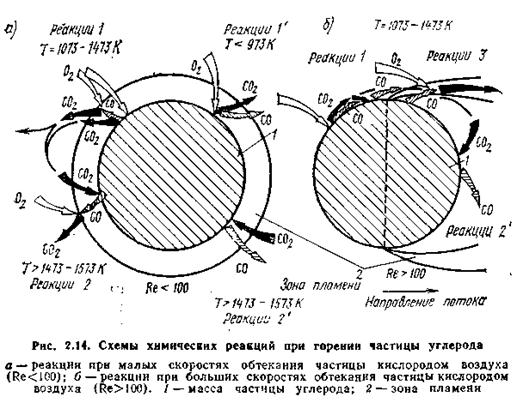 При этом возможны четыре режима взаимодействия углерода с кислородом воздуха в зависимости от температуры среды (рис.). Основными реакциями в модели считаются реакции углерода с кислородом, поступающим к поверхности частицы за счет диффузии из основного потока с образованием оксида и диоксида углерода. Продукты сгорания диффундируют от поверхности частицы в окружающее ее пространство. При невысоких температурах (<973 К) (реакция 1') реакции окисления углерода протекают с образованием СО и СО2. При более высоких температурах,(1070—1470 К) возможна вторичная реакция догорания образовавшегося СО вблизи поверхности частицы так, что в окружающую среду будет отводиться только или преимущественно диоксид углерода (СО2) (реакция 1). При этом часть образовавшегося СО2 может при Т= 1473—1573 К вновь продиффундировать к поверхности углерода и вступить с ним в эндотермическую реакцию с образованием оксида углерода (реакция 2), который затем догорит в результате взаимодействия с кислородом в зоне пламени вокруг частицы.
При этом возможны четыре режима взаимодействия углерода с кислородом воздуха в зависимости от температуры среды (рис.). Основными реакциями в модели считаются реакции углерода с кислородом, поступающим к поверхности частицы за счет диффузии из основного потока с образованием оксида и диоксида углерода. Продукты сгорания диффундируют от поверхности частицы в окружающее ее пространство. При невысоких температурах (<973 К) (реакция 1') реакции окисления углерода протекают с образованием СО и СО2. При более высоких температурах,(1070—1470 К) возможна вторичная реакция догорания образовавшегося СО вблизи поверхности частицы так, что в окружающую среду будет отводиться только или преимущественно диоксид углерода (СО2) (реакция 1). При этом часть образовавшегося СО2 может при Т= 1473—1573 К вновь продиффундировать к поверхности углерода и вступить с ним в эндотермическую реакцию с образованием оксида углерода (реакция 2), который затем догорит в результате взаимодействия с кислородом в зоне пламени вокруг частицы.
При высоких температурах (выше 1470—1570 К), как правило, кислород не достигает поверхности частицы и процесс горения протекает по гетерогенной реакции С+
+С02 = 2СО с последующим догоранием СО на некотором расстоянии от поверхности в зоне пламени (реакция 2'). В случае омывания частицы потоком окислителя с большой скоростью (Re>100) с лобовой стороны частицы будут протекать только гетерогенные реакции (реакции 1 и 2, рис. б); догорание же оксида углерода будет наблюдаться в кормовой части потока на границе циркуляционной зоны (реакция 3, рис. 2.14,6), а вторичные реакции C+C02 будут иметь место главным образом в тыльной части углеродной частицы (схема 2, рис. б), где кислород отсутствует, но имеются хорошие тепловые условия для обеспечения эндотермических реакций.
Важной отличительной особенностью горения коксового (углеродного) остатка частицы твердого топлива является его высокая пористость, что обеспечивает диффузию внутрь углеродной частицы активных по отношению к углероду газов (С02, 02, Н20). В ходе реагирования внутренняя поверхность частицы увеличивается за счет испарения влаги, выхода летучих веществ, изменения температуры и других факторов.
Чем больше проницаемость материала, интенсивнее диффузия газов внутрь его и чем медленнее протекает реакция, тем глубже проникание кислорода и других газов внутрь частицы и тем большая масса участвует в реакции. Процесс внутренней диффузии можно рассматривать как самостоятельный, не зависящий от характера диффузионных процессов в зоне горения.
Особенно значительна роль внутреннего реагирования при горении композиционных топлив — топливных гранул, капель топливных суспензий и др. С повышением температуры горения значение внутреннего реагирования ослабевает. При сжигании высокозольных твердых топлив даже при высоких температурах значение внутреннего реагирования существенно возрастает, так как зольная оболочка, образующаяся при выгорании такой частицы, становится дополнительным сопротивлением для диффузии газов к поверхности реагирования. Однако влияние этой оболочки на процесс сказывается только при горении крупных частиц топлива; при пылевидном сжигании даже при зольности топлива 30—35 % это влияние несущественно.
При горении частицы натурального твердого топлива стадии горения коксового (углеродного) остатка предшествует ряд факторов, существенно влияющих на процесс в целом, а именно: подогрев и подсушка частицы топлива; деструкция вещества топлива с выделением летучих; горение летучих и др. Важной особенностью горения этих частиц является четко выраженная стадийность с резким изменением характера закономерностей развития каждой стадии во времени. Экспериментальные исследования динамики выгорания частицы твердого топлива, выполненные практически на всех марках угля в широком диапазоне температур среды (от 573 до 1273 К), позволили создать модель горения частицы натурального топлива —угля, включающую 10, а для высоковлажных углей и водоугольных суспензий — 11 стадий процесса.
При вводе частицы в высокотемпературную окислительную среду она вначале проходит стадию прогрева 1 при определяющем влиянии внешнего теплообмена и массопереноса на изменение массы и температуры частицы. При выгорании частицы высоковлажного топлива или капли водоугольной суспензии вслед за стадией прогрева наблюдается стадия поверхностного испарения влаги, протекающая при постоянной температуре частицы. Собственно процесс горения частицы начинается со стадии 2 — стадии дальнейшего прогрева частицы и начала низкотемпературных экзотермических реакций внутри объема частицы, что приводит к достаточно резкому увеличению ее температуры при непрерывной скорости изменения температуры и потери массы.
Стадия 3 характерна уменьшением скорости роста температур в связи с началом эндотермических реакций деструкции угольного вещества с выходом летучих продуктов этой деструкции. Стадия завершается воспламенением летучих вокруг частицы, что приводит к интенсификации процессов деструкции внутри частицы. Эти процессы продолжаются во время 4 стадии — стадии горения летучих; 5—стадия параллельного протекания процессов горения летучих вокруг объема частицы и начала поверхностного гетерогенного горения углерода, о чем свидетельствует резкое возрастание температуры поверхности частицы; 6 — стадия активного поверхностного горения с догоранием вокруг поверхности еще выделяющихся летучих. Во время этой стадии достигается максимальная температура поверхности частицы.
Во время 1— 5 стадий происходит изменение структуры реагирующей частицы с резким увеличением ее пористости и активации открывающейся поверхности. На стадии 7 наблюдается активное горение коксового (углеродного) остатка частицы с догоранием еще выделяющихся летучих на ее поверхности. Эта стадия характеризуется резким падением температуры на поверхности частицы. 8 стадия — это горение коксового остатка, как правило, самая продолжительная стадия, протекающая при плавном снижении температуры поверхности и развитии реакций внутри объема частицы. Процесс горения заканчивается стадией догорания коксового остатка (стадия 9), в основе которой лежит внутреннее реагирование углерода частицы с диффундирующими внутрь ее газами, и стадией 10 — стадией охлаждения зольного остатка частицы до температуры среды. Важно, что практически все стадии протекают при разных режимах горения от чисто диффузионных (стадии 1,2,4,7,8,9) до кинетических (стадии 3, 6 ).
В целом же весь процесс выгорания частицы натурального твердого топлива суммарно можно рассматривать как протекающий в промежуточном режиме ближе к диффузионному, а для инженерных расчетов — в чисто диффузионном режиме. При термической деструкции угольного вещества (стадии 2, 3, 4, 5) происходит выделение продуктов деструкции в виде газа, кислоты, воды и смолы. Относительная доля выделяющихся газа и жидкости зависит от скорости нагрева частицы: чем выше скорость нагрева, тем выход этих веществ больше. По мере движения к поверхности частицы вода и кислоты испаряются, а смола и газообразные углеводороды подвергаются вторичному разложению. Водяной пар, проходя через раскаленную углеродную поверхность, на стадиях 4 и 5 может вступать в реакцию с углеродом и интенсифицировать процесс.
В конце 3 стадии процесса происходит воспламенение частицы топлива, которое практически во всех случаях начинается с воспламенения выделившихся из нее горючих летучих, имеющих более низкую температуру воспламенения, чем коксовый (углеродный) ее остаток. В связи с этим роль летучих в процессе воспламенения во многом является решающей. Выход летучих является следствием деструкции угольного вещества; чем выше интенсивность их выхода, тем больше глубина деструкции, прямым следствием которой является активация образующейся новой реакционной поверхности твердого остатка за счет повышения пористости частицы. Образование летучих в объеме частицы приводит к повышению ее внутреннего давления и к разработке поверхности твердого остатка, что способствует существенной интенсификации процесса горения в целом, особенно на заключительной его стадии.
В то же время выделяющиеся летучие обволакивают частицу и при определенных условиях [на стадии 4 и 5 (частично)] препятствуют диффузии кислорода к поверхности частицы и тем самым в известной степени несколько тормозят основные гетерогенные реакции горения. Однако, это наблюдается только у относительно крупной частицы размером 1,0 мм и более. Чем выше размер частицы, тем относительно меньшая доля летучих выделяется до момента их воспламенения и тем большая их часть выгорает параллельно с гетерогенным реагированием на поверхности частицы.
При сжигании частиц топлива в потоке большое значение в процессе воспламенения играет время индукции Тинд, т. е. время, затрачиваемое на самопроизвольное повышение температуры в процессе химического реагирования горючего с окислителем, приводящего к воспламенению. Величина Тинд определяется как промежуток времени, в течение которого температура частицы повышается от начальной до температуры воспламенения. Чем выше температура среды, в которую введена частица топлива, тем меньше время индукции. Для оценки процесса воспламенения твердых топлив иногда пользуются параметром условная температура воспламенения — минимальная температура среды, при которой происходит воспламенение частицы при длительном ее пребывании в ней (т. е. при Тинд стремится к бесконечности). Эта температура воспламенения зависит не только от вида топлива, но и от тепловых условий взаимодействия частицы со средой. Так, для одиночной мелкой частицы эта температура меняется от 1170—1270 К для антрацита до 800—850 К для бурого угля. Для частиц тех же топлив, находящихся в контакте с другими такими же частицами (например, в слое), эта температура снижается почти в 2 раза, что свидетельствует о более благоприятных условиях воспламенения топлива при слоевом его сжигании.
При инженерных расчетах времени горения частицы твердого топлива стадии горения условно объединяют в четыре укрупненные расчетные стадии:
1) от момента ввода частицы в зону горения до момента воспламенения летучих (стадии /, // и III); время этой стадии рассчитывают как время выхода летучих Твл;
2) от момента воспламенения летучих до конца их видимого горения (стадии 4, 5); время этой стадии рассчитывают как время видимого горения летучих Тгл;
3) от момента прекращения видимого горения летучих до начала активного горения коксового остатка (стадия 4); время стадии рассчитывают как время прогрева коксового остатка до его воспламенения Твл; 4) от момента начала активного горения коксового остатка до завершения процесса (стадии 7, 8,9); время стадии рассчитывают как время горения коксового остатка Тгк).
Эти условные времена расчетных стадий горения частицы рассчитывают на основании экспериментальных данных, полученных при изучении изменения цветовой температуры частицы в процессе горения, а также визуального наблюдения за процессом с применением киносъемки. Расчетные зависимости позволяют определить влияние начального размера частицы d, мм; температуры среды Тт, К; концентрации кислорода 02, %; плотности частицы рчт, кг/м3, на время протекания расчетных стадий процесса.
Время расчетной стадии горения летучих (2—3) определяется только величиной поверхности частицы топлива, поскольку горение летучих протекает вокруг частицы и не зависит ни от температуры среды, ни от других параметров. Время протекания расчетной стадии горения коксового остатка Тгк линейно зависит от концентрации кислорода, пропорционально поверхности частицы d2.
Горение жидкого топлива. Жидкое топливо в топочных устройствах, как правило, сжигается в распыленном состоянии, в виде капель в потоке воздуха. Горение жидких топлив всегда происходит в паровой фазе, поэтому процессу горения капли всегда предшествует процесс испарения. В общем случае в высокотемпературной среде капля жидкого топлива окружена некоторой зоной, насыщенной его парами, на внешней поверхности которой вокруг капли устанавливается сферическая зона горения. Скорость химической реакции смеси паров жидкого топлива с окислителем достаточно велика, так что толщина зоны горения по отношению к диаметру зоны горения незначительна. Толщина паровой зоны вокруг капли топлива зависит от температуры в зоне горения и от параметров испарения топлива: чем выше температура горения и чем ниже температура кипения топлива и теплота его испарения, тем выше толщина паровой зоны.
В стационарном процессе скорость горения жидкого топлива в случае, если все оно выгорает в зоне вокруг капли, зависит от скорости его испарения. В пространстве между зоной горения и каплей находятся пары топлива и некоторая часть продиффундировавших туда продуктов сгорания, а вне зоны горения — окислитель и продукты сгорания (рис. 2.16). В зону горения из объема капли диффундируют пары топлива, а с внешней стороны — окислитель (кислород воздуха). В результате реакции с выделением теплоты образуются продукты сгорания, которые в основном отводятся в окружающее каплю пространство. Теплота, необходимая для испарения топлива, передается поверхности капли из зоны горения в основном излучением и в результате частичной диффузии внутрь паровой оболочки продуктов сгорания. При таких предпосылках время горения капли жидкого топлива в диффузионном режиме может быть рассчитано на основании теплового баланса ее испарения.

Область распространения факела можно условно разделить на следующие зоны: распыления топлива, его испарения и образования газовоздушной смеси, воспламенения и горения этой смеси. Как по сечению топливно-воздушной струи, так и по ее длине в процессе горения непрерывно изменяются температура и концентрация топлива и окислителя. При этом возможно образование локальных зон, в которых концентрация топлива будет выше теоретически необходимой. Не допустить образования таких зон — значит обеспечить высокую полноту выгорания жидкого топлива. Для производства тепловой энергии из нефтяных топлив применяют лишь мазут и печное бытовое топливо.
Горение газообразного топлива в потоке воздуха отличается от горения жидкого и твердого топлива тем, что оба реагирующих компонента (горючее и окислитель) находятся в одной газообразной фазе, поэтому возможны организация горения этого топлива как при полном (до молекулярного уровня) предварительном перемешивании реагирующих компонентов, так и без такого перемешивания, а также организация горения газовоздушной смеси, содержащей недостаточное для полного сгорания количество воздуха. Горение однородной газовой смеси происходит стационарно в некоторой зоне потока, в которую непрерывно поступает горючая смесь и из которой также непрерывно отводятся продукты сгорания.

В топочный объем газовоздушная смесь, как правило, вводится через сопло относительно малого сечения, в результате чего образуется турбулентная газовая струя. При входе в топочный объем струя газовоздушной смеси расширяется по направлению движения за счет эжектирования в нее газов с высокой температурой из окружающего струю пространства и одновременно частично разбавляется продуктами сгорания за счет поперечных турбулентных пульсаций (рис. 2.17). В соответствии с теорией развития неизотермических струй в результате взаимодействия струи с окружающим ее нагретым пространством происходит ее нагрев в турбулентном пограничном слое. В ядре струи, где газы движутся с постоянной скоростью, равной скорости начального участка струи, температура остается постоянной и равной температуре газовоздушной смеси на выходе из сопла. В результате нагрева смеси в периферической зоне струи она воспламеняется, образуя зону горения, расширяющуюся по мере удаления от устья сопла. В ядре струи смесь не горит.
При организации горения газовоздушной смеси с недостаточным количеством воздуха только часть горючего сгорает, реагируя с кислородом, содержащимся в смеси. Несгоревшая часть горючего вместе с продуктами сгорания взаимодействует с кислородом окружающей среды, образуя вторую зону горения, положение которой подчиняется законам диффузионного горения.
Таким образом, пространство, занимаемое горящим факелом, делится на три области: 1) область между горелкой и первым фронтом пламени, где смесь еще не горит; 2) область между двумя зонами горения, где находится несгоревшее в первой зоне горения горючее; 3) область вне диффузионной зоны горения, где находится смесь продуктов сгорания с окислителем. Как и в случае чисто диффузионного горения, для полного протекания реакции здесь также решающее значение имеет смесеобразование.
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 5361; Нарушение авторских прав?; Мы поможем в написании вашей работы!