
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
В живых организмах присутствуют комплексные соединения биогенных металлов
|
|
|
|
Связь плоской прямоугольной и полярной систем координат
Простота полярной системы координат и возможность ее построения относительно любой точки местности, принимаемой за полюс, обусловили ее широкое применение в топографии. Чтобы связать воедино полярные системы отдельных точек местности, необходимо перейти к определению положения последних в прямоугольной системе координат, которая может быть распространена на значительно большую по площади территорию. Связь между двумя системами устанавливается решением прямой и обратной геодезических задач.
Прямая геодезическая задача состоит в том, что по известным
координатам точки А (ХА;YА), горизонтальному проложению S линии АВ и дирекционному углу, вычисляют приращения координат х; у и координаты точки В (ХВ;YВ). Приращениями координат х и у называются разности координат конечной В и начальной А точек линии АВ. Значения приращений определяются из прямоугольного треугольника АВС по заданным S и:
х= S cosα; у = S sinα.
В зависимости от названия четверти прямоугольной системы координат приращения х и у имеют определенные знаки.
Координаты конечной точки В вычисляются по формулам:
ХВ = ХА + Δ х; YB = YA + Δу.
Обратная геодезическая задача заключается в том, что по известным координатам начальной точки А (ХА; YА) и конечной точки В (ХВ и YВ) определяют горизонтальное проложение S и дирекционный угол линии АВ.
Контрольные вопросы:
1. Измерение дирекционных углов и азимутов на карте
2. Определение плановых координат и измерение ориентирующих направлений на топографических картах
3. Связь плоской прямоугольной и полярной систем координат
Литература:
1. Дьяков Б. Н. Геодезия. Общий курс: учеб. пособие дл я
|
|
|
2. вузов. − Новосибирск: Изд. НГ У, 1993. − 169 с.
3. 4Дьяков Б. Н. Геодезия. Общий курс. Новосибирск:
4. СГ Г А, 1997. 173 с.
5. Инженерная геодезия. Учеб. для вузов / К л ю ш ин Е. Б.,
6. Киселев М. И., Мих е л е в Д. Ш., Ф е л ь д м а н Е. Д.: П од
ред. Мих е л е в а Д. Ш. − 2-е изд. испр. − М.: Высш. ш к.,
2001. − 464 с.: ил.
7. Инструкция по топосъемкам масштабов 1: 5000 – 1: 500
− М.: Недра, 1973. с.
8. Кузнецов П. Н. Г еодезия. Ч. 1. М.:, 2002. с.
9. Маслов А. В. и др. Г еодезия / Ма с л ов А. В., Л а р ч е н к о Е.
10. Г., Гор д е е в А. В., Ал е к с а н д р ов Н. Н. Ч. 1. – М.:
Издател ьство геодезич еской л итерату ры, 1958. 512 с.
11. Маслов А. В. Г еодезия. Ч. 1. М.: Недра, 1980.
Маслов А. В., Юн у с ов А. Г.Ю Гор ох ов Г. И
- с белками,
- витаминами и др.
- комплексные соединения играют роль
- -ферментов
- - выполняют специфические функции в обмене веществ
u Характерной особенностью комплексных соединений является наличие в них химической связи, возникшей по донорно-акцепторному механизму:

• Комплексные соединения - устойчивые химические соединения сложного состава, в которых обязательно имеется хотя бы одна связь, возникшая по донорно-акцеп-торному механизму.
• В каждом комплексном соединении различают внутреннюю и внешнюю сферы:
• K 3+ [Al(OH)6]-3 [Сu(NH3)4]+2 (NO3)2
• Комплексообразователь (центральный атом) - атом или ион, который является акцептором электронных пар, предоставляя свободные атомные орбитали, и занимает центральное положение в комплексном соединении.
• Роль комплексообразователя выполняют
• -----атомы или ионы d- и f-металлов;
• -----Атомы неметаллов с различной положительной степенью окисления: В +3, S +6, S +4.
• ---- Отрицательно заряженные ионы неметаллов: N 3–, I –, S 2–.
• Число свободных атомных орбиталей, предоставляемых комплексообразователем, определяет его координационное число- оно равно удвоенному заряду иона комплексообразователя.
|
|
|
•
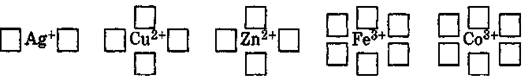
• В комплексных соединениях комплексообразователь связан с лигандами.
u Лиганды - молекулы или ионы, которые являются донорами электронных пар и непосредственно связаны с комплексообразователем.
u Лиганды-анионы:
u

Лиганды-молекулы

• По числу связей, образуемых лигандом с комплексообразо-вателем, лиганды делятся на моно-, би- и полидентатные
• Внешняя сфера комплексного соединения — это положительно или отрицательно заряженные ионы, нейтрализующие заряд комплексного иона и связанные с ним ионной связью

• Теории строения комплексных соединений.
• 1. С точки зрения электростатической теории В.Косселя и А.Магнуса образование комплексных соединений обусловлено действием кулоновских сил-притяжением между центральным катионом металла и анионами или полярными молекулами лигандов
• ---- не объясняла многие свойства комплексных соединений — магнитные свойства, окраску, реакционноспособность
• 2. В 1891 г. швейцарский учёный Альфред Вернер предложил координационную теорию комплексных соединений, которая легла в основу и современных представлений.
• 3. теории кристаллического поля.
• - лиганды создают электростатическое поле, под действием которого меняется энергия электронных орбиталей центрального иона. При этом меняется распределение электронов. На орбиталях центрального атома освобождаются места для электронов лиганда. Освободившиеся орбитали используются для образования донорно-акцепторной связи с лиганд
• Метод валентных связей.
• --Связь между центральным атомом и лигандами донорно-акцепторная. Лиганды предоставляют электронные пары, а ядро — свободные орбитали.
• -----Мерой прочности служит степень перекрывания орбиталей. Обобществление электронных пар донора и акцептора сопровождается выделением энергии.
• Так как запас энергии уменьшается, связь становится устойчивой.
• ----Донорно-акцепторная связь характеризуется направленностью, отсюда конфигурация комплексного иона строго определённая.
• -----Строение и прочность комплекса зависят от характера орбиталей, участвующих в гибридизации
• Классификация комплексных соединений.
|
|
|
• I тип: комплексные соединения с одинаковыми лигандами называются однородными, а с разными лигандами — неоднородными.
• II тип: за основу берётся химическая природа комплекса [комплексы катионные, анионные, нейтральные].
• III тип: наиболее распространена классификация по химической природе лигандов.
• 1. Аммиакаты —: [Ag(NH3)2]Cl.
• 2. Ацидокомплексы: лиганды — анионы кислот: К3[Fe(CN)6].
• 3. Аквакомплексы — лигандами являются молекулы воды: [Со(Н2О)6]SО4.
• 4. Гидроксокомплексы — лигандами являются гидроксогруппы: К3[Al(ОН)6].
• 5. Сверхкомплексные соединения: число лигандов превышает координационное число:
• [Cu(H2O)4]SO4 • H2O
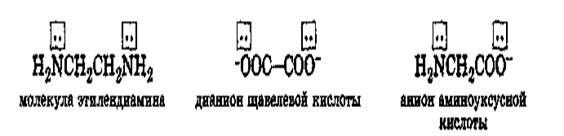
• 6. Внутрикомплексные соединения: Комплексообразователь как бы втянут внутрь лиганда [хелат — «клешня рака»]. лиганды — сложные молекулы, образующие с комплексообразователем помимо донорно-акцепторной связи, ещё ковалентные связи:
• H2C—H2N NH2—CH2
• Cu
• O=C—O O—C=O
• В живых организмах в полидентных лигандах донорные атомы связаны в единое кольцо-цикл.
• - порфирины [железо в гемоглобине, магний в хлорофилле, кобальт в витамине В 12 ].
• Полидентные лиганды связываются с ионами металла гораздо сильнее, чем монодентные с теми же донорными атомами [прочность комплексов на 8–10 порядков выше].
• Повышенная прочность комплексных соединений с полидентными лигандами называется хелатным эффектом.
• Чем выше заряд ионов-комплексообразователей и выше основность лигандов, тем выше хелатный эффект.
• Хелатный эффект снижается, если ион сильно гидратирован и имеет малый радиус.
• Так как ионы Н + конкурируют с ионами металла, повышение кислотности среды снижает хелатный эффект.
u Международная (Женевская) номенклатура КС
u I. КС разбивается на внешнюю и внутреннюю сферы. вначале дается название аниона, а потом катиона:
u II. Комплекс называется следующим образом:
u а) сначала перечисляются лиганды с указанием их числа в комплексе;
u б) лигнады-анионы называются с добавлением окончания ”о”:OH- - гидроксо, F- - фторо и т.д.
|
|
|
u г) нейтральные лиганды называются так же как молекулы: Cl2 - хлор, и т.д. (исключения: H2O - аква, NH3 - аммин, CO
u после перечисления лигандов дается название комплексообразователя с указанием его заряда:.
u --- Катионный комплекс - по-русски в родит. падеже:
u [Co+2(H2O) 06]SO4 -2 - сульфат гексааквакобальта (+2);
u --- анионный комплекс то название комплексообразователя - по-латыни с окончанием “ат”:
u K3[Fe+3(CN) -1 6] - гексацианоферрат (+3) калия.
u ---- если комплекс не заряжен, то комплексообразователь называется по-русски в именительном падеже:
u [Fe0(CO)0 5] - пентакарбонилжелезо;
Изомерия комплексных соединений.
1. Сольватная [гидратная]: различие в распределении воды во внутренней и внешней сфере:
[Cr(H2O)6]Cl3 [Cr(H2O)5Cl]Cl2•H2O
фиолетовый светло-зелёный 2. Ионизационная изомерия: различное распределение ионов между внешней и внутренней сферами:
[Co(NH3)5SO4]Br [Co(NH3)5Br]SO4
красный красно-фиолетовый
3. Геометрическая изомерия обусловлена различным пространственным расположением лигандов неоднородного комплекса в одной и той же внутренней сфере:
NH3 Cl NH3 Cl
/ /
Pt Pt
/ /
NH3 Cl Cl NH3
оранжевый [цис] светло-зелёный [транс]
Различное биологическое действие: цис -изомер используется в онкологической практике.
4. Координационная изомерия [переход лигандов от одного комплексообразователя к другому].
u КС диссоциирует:
u [Ag(NH3)2]Cl = [Ag(NH3)2]+ + Cl–
u комплексные ионы обратимо дисоциируют:
u [Ag(NH3)2]+ «Ag+ + 2NН3
u  закон действующих масс:
закон действующих масс:
u
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 1071; Нарушение авторских прав?; Мы поможем в написании вашей работы!