
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Степень окисления и валентность
|
|
|
|
Ранее было показано, что при образовании ковалентной связи электронные пары располагаются симметрично относительно ядер взаимодействующих атомов и атомы в молекулах никаких зарядов не несут.
При образовании ионных связей валентные электроны переходят от менее электроотрицательных (ЭО) к более электроотрицательным атомам, в результате чего образуются ионы, заряд которых определяется количеством отданных или присоединенных электронов. В молекулах с полярными связями валентные электроны лишь частично смещаются к более ЭО атому, при этом на взаимодействующих атомах возникают электрические заряды, но их величины не являются целочисленными. Например, в молекуле HCl на водороде существует положительный, а на Cl - отрицательный заряды, но их величины меньше 1.
В практических целях (при составлении уравнений окислительно-восстановительных реакций) заряды на атомах в молекулах с полярными связями удобно представлять в виде целых чисел, равных таким зарядам, которые возникли бы на атомах, если бы валентные электроны полностью переходили к более электроотрицательным атомам, т.е. если бы связи были полностью ионными. Такие величины зарядов получили название степеней окисления. Степень окисления любого элемента в простом веществе всегда равна 0.
В молекулах сложных веществ некоторые элементы всегда имеют постоянную степень окисления. Для большинства элементов характерны переменные степени окисления, различающиеся как знаком, так и величиной, в зависимости от состава молекулы.
У щелочных металлов, а также у металлов главной подгруппы второй группы степень окисления во всех соединениях равна соответственно +1 и +2. Постоянную степень окисления, равную -1, имеет фтор. Кислород, как правило, имеет степень окисления -2. У водорода в соединениях с неметаллами степень окисления +1, в гидридах металлов - -1. Для того, чтобы отличить значения степени окисления от зарядов ионов в первом случае знак ставится перед цифрой, во втором - после цифры. Например, Н+1Cl-1, но Na1+Cl1-.
Часто степень окисления (СО) равна валентности и отличается от нее только знаком. Но встречаются соединения, в которых степень окисления элемента не равна его валентности. Как уже отмечалось, в простых веществах СО элемента всегда равна нулю независимо от его валентности. В таблице сопоставлены валентности и степени окисления некоторых элементов в различных соединениях.
| соединение | элемент | валентность | схема | степень окисления |
| О2 | кислород | О=О | ||
| Н2О | 
|   О
Н О
Н  Н Н
| -2 +1 | |
| Н2О2 | 
| Н→О – О←Н | -1 +1 | |
| N2 | азот | N≡N | ||
   NH3 NH3
| 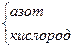
| H N H H | -3 +1 | |
   NF3 NF3
| 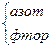
| F N F F | +3 -1 | |
    N2H4 (гидразин) N2H4 (гидразин)
| 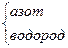
| H H N—N H H | -2 +1 | |
    NH2OH (гидроксил-амин) NH2OH (гидроксил-амин)
| 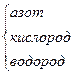
| H N O H H | -1 -2 +1 |
Определение степени окисления элемента в какой либо молекуле сводится к простой арифметической операции, так как сумма степеней окисления атомов всех элементов, входящих в состав молекулы, равна нулю. Например, необходимо определить степень окисления фосфора в фосфорной кислоте Н3РО4. Поскольку у кислорода СО – -2, а у водорода - +1, то для нулевой суммы у фосфора степень окисления должна быть равна 5:
[3(+1)+1(+5)+4(-2)=0].
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 527; Нарушение авторских прав?; Мы поможем в написании вашей работы!