
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика примесей природных вод
|
|
|
|
По степени дисперсности примеси природных вод могут быть разделены на
А) грубодисперсные,
Б) коллоидно-дисперсные
В) истинно-растворенные.
Грубодисперсные примеси (ГДП) представляют собой агломераты с размером частиц более 100 нм. Они образуют с водой гетерогенную систему. Сравнительно большая масса отдельных частиц таких примесей позволяет им заметно проявлять себя в поле сил тяжести, т. е. дисперсная система грубодисперсных веществ в воде обладает малой седиментационной устойчивостью. Грубодисперсные частицы распределяются в массе воды механически и практически не способны к диффузии. В зависимости от значения 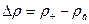 (где ∆ρч и ∆ρ в — соответственно плотность частицы и воды) они могут подразделяться на
(где ∆ρч и ∆ρ в — соответственно плотность частицы и воды) они могут подразделяться на
а) тонущие (∆ρ >0),
б) взвешенные (∆ρ = 0)
в) всплывающие (∆ρ <0).
Система грубодисперсная примесь — вода может образовывать эмульсию, если грубодисперсная примесь—жидкость, или суспензию, если примесь — твердое тело. Следует подчеркнуть, что в нижней границе дисперсного спектра (ближе к 100 нм) грубодисперсные примеси выделяются из воды с большим трудом и могут пребывать в ней значительное время, обусловливая мутность воды. Именно из-за наличия в воде таких примесей пользуются выражением: взвешенные вещества. Грубодисперсные примеси обычно состоят из глинистых веществ, песка и органических веществ.
Коллоидно-дисперсные примеси также образуют с водой гетерогенную систему. Коллоидные частицы имеют весьма малые размеры (от 1 до 100 нм) и поэтому не теряют способности к диффузии (участвуют в броуновском движении) и обладают весьма развитой удельной поверхностью. Так, суммарная удельная поверхность коллоидных частиц диаметром 10 нм (10 ~8 м) каждая в 105 раз превышает удельную поверхность грубодисперсной частицы равновеликой массы диаметром 10 м и составляет примерно 10"1 м2.
Коллоидные примеси в природной воде обладают очень большой седиментационной (равномерным распределением примесей по объему воды), а также и агрегативной устойчивостью. Под последней следует понимать неизменяемость дисперсного состава в течение длительного времени.
Коллоидные частицы невидимы даже при самом большом увеличении в биологическом микроскопе. В природных водах в коллоидном состоянии обычно находятся различные формы кремниевой кислоты, соединения алюминия и железа, а также различные органические вещества.
Истинно-растворенные примеси представлены в воде в виде отдельных ионов, молекул или комплексов, состоящих из нескольких молекул. Частицы таких примесей имеют размер менее 1 нм. Так как такие примеси не имеют поверхности раздела, то вместе с водой они составляют гомогенную систему.
По химическому характеру примеси разделяются
а) Газовые примеси в природной воде составляют газы, растворенные в воде из-за ее контакта с атмосферой (О2, СО2, N2), и газы, образующиеся в результате биохимических процессов (H2S, SO2, NH3).
б) К минеральным примесям относятся растворенные минеральные соли.
в ) Органические вещества в природных водах представлены в основном гумусовыми веществами. Кроме того, в воде могут находиться таннины, белки, жиры, эфирные масла и др. Особенно богаты гумусовыми веществами болотные воды и воды торфяников. Именно эти вещества придают воде коричневую или желтую окраску. Гумусовые вещества в общем случае разделяют условно на гуминовые кислоты (находящиеся в воде в виде коллоидов), коллоидные фульвокислоты и истинно-растворенные фульвокислоты. Соединения гуминовых кислот с ионами Na+ и К+ хорошо растворимы, а с Са2 + и Mg2+ —трудно растворимы и могут образовывать в воде коллоиды. Фульвокислоты образуют хорошо растворимые соединения с ионами Na+, K+, NH4, Fe2 + и плохо растворимые соединения с ионами А13+ и Fe3 +.
Кроме того, в результате сброса в водоемы сточных вод в природных водах могут присутствовать другие органические соединения: нефтепродукты, фенолы, поверхностноактивные вещества, ароматические соединения и т. п.
Ионный состав примесей воды характеризуется присутствием в ней соответствующих катионов и анионов (табл. 1.3).
Ионы Na+ и К+ относятся к числу устойчивых примесей воды, так как они не образуют труднорастворимых солей и не подвергаются гидролизу, т. е. не вступают в реакцию с водой. Обычно концентрация ионов К+ составляет менее 10% концентрации ионов Na+, и поэтому при анализе их не определяют отдельно, а выражают суммарное содержание ионов этой группы через концентрацию ионов Na+.
| группа | катионы | анионы | Концентрация, мг/кг |
| Na+,K+,Mg2+,Ca2+ | HCO-3, Сl-, SO2-4 | От единиц до десят- ков тысяч | |
| NH+4, Fe2 +, Mn2+ | HSiO-3, F-, NO-3 СО2-3 | От десятых долей до единиц | |
| Cu2 +, Zn2 +, Ni2 + Al3+ | HS-, I-, NO-2, H2PO-4 | Меньше десятых долей |
Таблица 1.3. Важнейшие ионы в природных водах
Фактические значения рН, определенные экспериментально, могут относиться к значению рН в положении равновесия как рНфакт <> рНравн. Разность между экспериментально найденным значением рНфакт и рНравн называется индексом стабильности воды:
U с = рНфакт - рНравн.
При значении Uс = 0 вода стабильна, при Uc<0 вода агрессивна, а при Uc>0 она нестабильна и способна к образованию отложений.
Экспериментально стабильность воды можно определить также путем контактирования пробы воды с карбонатом кальция в течение 1—2 ч и измерения значения рН до (pH1) и после (рН2) контактирования. При этом принимается, что если отношение рН1/рН2 = 1, то вода стабильна. При рН1/рН2>1 вода нестабильна, а при рН1/рН2<1 она агрессивна.
Следует подчеркнуть, что состояние равновесия достигается в течение длительного времени, поэтому возможно также и пребывание описанной системы в состоянии некоторого пересыщения по СаСО3, когда количество выпавшей твердой фазы оказывается меньше расчетного.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 1903; Нарушение авторских прав?; Мы поможем в написании вашей работы!