
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обратный осмос и ультрафильтрация
|
|
|
|
Методы обратного осмоса и ультрафильтрации заключаются в фильтровании растворов через специальные полупроницаемые мембраны. При этом либо мембрана пропускает только молекулы растворителя (воды), либо частично с растворителем проходят ионы и молекулы задерживаемых веществ. При обратном осмосе осуществляется отделение частиц (молекул, гидратированных ионов), размеры которых сопоставимы с размерами молекул растворителя, тогда как при ультрафильтрации минимальные размеры задерживаемых частиц на порядок больше, причем максимальные их размеры не должны превышать 0,5 мкм.
Если частицы имеют размеры более 0,5 мкм, для их отделения необходимо применять собственно фильтрование. Иногда нижний предел частиц, удаляемых ультрафильтрацией, характеризуют их молекулярной массой, равной 500.
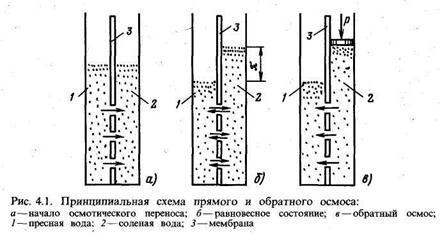
В основу процесса обратного осмоса положено явление осмоса — самопроизвольного перехода растворителя через специальную полупроницаемую перегородку (мембрану) в раствор. Если какую-либо ячейку разделить мембраной и залить левую часть чистой водой, а правую раствором (рис. 4.1), то будет наблюдаться самопроизвольный переход молекул воды из левой части в правую. Движущей силой процесса при •ном является разность концентраций воды в левой и правой частях ячейки. При этом уровень воды в левой части ячейки будет понижаться, а в правой повышаться. Вследствие возникновения гидравлического напора за счет разности уровней воды в обеих частях ячейки вода будет переходить из правой части ячейки в левую, причем скорость перехода воды слева направо будет падать вследствие убывания разности концентраций примесей по обе стороны мембраны (разбавление раствора в правой части ячейки), а скорость перехода воды справа налево будет возрастать из-за увеличения разности уровней по обе стороны мембраны. Естественно, что при определенном гидростатическом давлений наступит равновесие такой системы, когда уровни в обеих частях ячейки не будут изменяться. Гидростатическое давление, соответствующее равновесному состоянию такой системы, называется осмотическим давлением.
Если со стороны раствора приложить внешнее давление, превышающее осмотическое, то скорость перехода через мембрану воды из раствора будет большей, чем воды в раствор.
Таким образом, движущая сила процесса обратного осмоса с учетом того, что мембраны обычно пропускают некоторое количество ионов вместе с водой и фильтрат представляет собой раствор, но значительно менее концентрированный, чем исходный, будет равна
∆Р=Р-(π1- π 2), (1)
где Р —избыточное давление над исходным раствором; π 1 и π2 — осмотическое давление сответственно исходного раствора и раствора, прошедшего через мембрану.
Осмотическое давление раствора в общем случае определяется согласно уравнению Вант-Гоффа
 (2)
(2)
где i=1—а — коэффициент Вант-Гоффа (а —степень диссоциации растворенного вещества); R —универсальная газовая постоянная, равная 8,3143 Дж/(моль- К); Т —абсолютная температура раствора, К; С—концентрация растворенного вещества, кг/м3; М —масса 1 моля растворенного вещества, кг.
Эмпирический коэффициент Вант-Гоффа равен среднему суммарному числу частиц, образующихся цри электролитической диссоциации одной молекулы:
i=1 + (v-l)a, (3)
где v — общее число ионов, образующихся при диссоциации одной молекулы.
В достаточно разведенных растворах или сильнорастворимых веществах можно считать диссоциацию полной, и тогда коэффициент Вант-Гоффа можно брать как целую величину в зависимости от числа ионов, образующихся при диссоциации молекулы вещества (например, для NaCl = 2).
Из (2) видно, что осмотическое давление зависит от химической природы растворенного вещества и его концентрации. Например, для раствора NaCl концентрацией 35 кг/м3 (примерно равной солесодержанию океанской воды) при Т= 293 К осмотическое давление
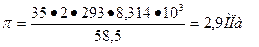 .
.
При разделении воды и растворенных в ней примесей требуются затраты энергии не менее определенного минимального ее количества, равного необходимому (согласно термодинамическому расчету) для обратимого отделения воды. Минимальная энергия, требующаяся для обратимого переноса I моля воды через мембрану, например, при разделении морской воды, оценивается 45,2 Дж/моль, или 0,58 кВт•ч/моль. Это значение получено термодинамическим расчетом, и поэтому оно справедливо для любых процессов разделения морской воды.
Однако при затрате минимального значения свободной энергии скорость разделения раствора практически равна нулю. Поскольку в реальных процессах производительность установок должна быть технологически приемлемой, то и рабочее давление в них должно значительно превосходить осмотическое. Обычно рабочее давление поддерживается в интервале 5—8 МПа.
В растворах, содержащих высокомолекулярные вещества с максимальным диаметром частиц 0,5 мкм (или молекулярной массой не более 500), осмотическое давление пренебрежимо мало. Для их разделения применяют процесс ультрафильтрации на специальных мембранах, пропускающих лишь воду, ионы и молекулы низкомолекулярных соединений. В этом случае рабочее давление в аппарате не превышает 0,5 МПа.
Обратный осмос и ультрафильтрация принципиально отличны от процессов фильтрования, так как при их осуществлении образуется не осадок, как при фильтровании, а лишь два раствора с разными концентрациями примесей.
Образование же осадка на мембранах недопустимо во избежание их засорения и снижения эффективности работы.
Несмотря на кажущуюся простоту процесса обратного осмоса и ультрафильтрации до настоящего времени нет единого взгляда на механизм перехода воды через мембраны.
Существует несколько гипотез, объясняющих процесс отделения воды от солей при фильтровании воды через мембрану: гиперфильтрационная (ситовая), сорбционная, диффузионная, электростатическая и др. Среди них наибольшее применение имеют две первые гипотезы.
Согласно сорбционной модели механизм перехода воды. через мембрану заключается в адсорбировании на поверхности мембраны и в ее порах молекул воды. В результате этого на поверхности мембраны образуется слой пресной воды (толщиной). Считается, что вода в этом слое обладает аномальными свойствами: почти полной потерей растворяющей способности, пониженной подвижностью и т. п. При диаметре пор мембраны d < 2 l через них будет проходить только вода, а растворенные вещества будут задерживаться.
Эта модель хорошо описывает процесс разделения воды и растворенных примесей при фильтровании растворов через мембраны из гидрофильных веществ, в частности через ацетилцеллюлозные мембраны.
Большинство советских исследователей придерживаются гиперфильтрационной гипотезы, согласно которой в полупроницаемой мембране имеются поры с диаметром, достаточным, чтобы пропускать молекулы воды (dH20 =0,276 нм), но малым для прохождения гидратированных ионов (d > 0,4 нм) и молекул растворенных веществ.
Однако в реальных мембранах невозможно практически создать поры одинакового размера, и поэтому всегда имеются более крупные поры, через которые могут проходить кроме молекул воды также и гидратированные ионы, что и объясняет явление селективности.
Кроме наличия в мембране пор определенных размеров при рассмотрении гиперфильтрационной модели учитывается также, что молекулы (частицы) в жидкости колеблются (каждая) около временных положений равновесия, т. е. переходят из одного временного положения равновесия в другое. Таким образом, если мембрана разделяет чистую воду и раствор, то в какой-то момент времени растворенная в воде частица может перекрыть полностью пору в мембране для прохода воды, но в другой момент времени частица скачком откроет пору для молекулы воды.
Эффективность процессов обратного осмоса и ультрафильтрации в значительной мере определяется свойствами применяемых мембран, которые должны отвечать следующим требованиям: он должен обладать высокой разделяющей способностью (селективностью), высокой удельной проницаемостью, устойчивостью к действию среды, неизменностью характеристик в процессе эксплуатации, достаточной механической прочностью, иметь низкую стоимость.
На практике пользуются понятием «проницаемость мембраны», которая выражается количеством фильтрата V, получаемого с единицы поверхности мембраны F в единицу времени τ:
G=V/(Fτ).
Проницаемость зависит от состава раствора, внешнего давления и типа мембраны.



 При эксплуатации под влиянием высокого давления воды и засорения мембран их проницаемость снижается. Лучшие свежие мембраны имеют проницаемость при давлении 5 МПа свыше 15м3/(м2-с). Так как стоимость мембран составляет около 20% стоимости очистки воды в процессе обратного осмоса, вопрос о продолжительности их работы является крайне важным. В настоящее время некоторые типы мембран успешно эксплуатируются 2—3 года.
При эксплуатации под влиянием высокого давления воды и засорения мембран их проницаемость снижается. Лучшие свежие мембраны имеют проницаемость при давлении 5 МПа свыше 15м3/(м2-с). Так как стоимость мембран составляет около 20% стоимости очистки воды в процессе обратного осмоса, вопрос о продолжительности их работы является крайне важным. В настоящее время некоторые типы мембран успешно эксплуатируются 2—3 года.
Селективность мембран в процессе разделения определяется выражением
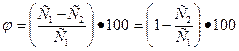
С 1 и С2 —концентрация растворенного вещества соответственно в исходной воде и фильтрате. Селективность возрастает с увеличением доли мелких пор в мембране.
Селективность разделения зависит как от свойств мембраны, так и от свойств разделяемых веществ, в частности от диаметров ионов в гидратированном состоянии. Она увеличивается с возрастанием этих диаметров.
Установлено также, что селективность мембраны улучшается с увеличением заряда ионов. Таким образом, удержание ионов мембранами может быть представлено рядами селективности (как при ионном обмене): для катионов Са2+ >Mg2+ >Na +, а для анионов СО32- >SO42->C1-. Обычно селективность мембраны определяется по раствору NaCl, и ее величина входит в марку мембраны (например, МГА-80—мембрана гиперфильтрационная, ацетатная с селективностью по NaCl не менее 80%). Селективность некоторых типов мембран достигает 95—99%.
При движении раствора над мембраной происходит непрерывный отток воды через нее и концентрация примесей в потоке возрастает. При этом максимальная концентрация наблюдается у поверхности мембраны. Повышение концентрации солей у поверхности мембраны (концентрационная поляризация) приводит к увеличению осмотического давления и возможности образования осадка на мембране согласно закономерностям, изложенным в гл. 2
Следует подчеркнуть, что увеличение селективности мембраны неизбежно приводит к снижению ее проницаемости (табл. 4.1), поэтому на практике приходится создавать марки мембран с высокой селективностью и малой проницаемостью и наоборот для различных условий проведения процесса обратного осмоса.
В последнее время в промышленности применяются следующие аппараты для обратного осмоса и ультрафильтрации: с плоскими мембранами (фильтр прессового типа); с трубчатыми мембранами диаметром 10—60 мм, которые укладываются внутри перфорированных трубок; со спиралевидными (рулонными) мембранами; с мембранами в виде полых волокон с внутренним диаметром 24—80 мкм. Разнообразие фильтрующих элементов и аппаратов объясняется прежде всего стремлением упаковать в единицу объема аппарата как можно большую фильтрующую поверхность, чтобы снизить его габариты, а также желанием учесть эксплуатационные возможности для проведения процесса обратного осмоса.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 1412; Нарушение авторских прав?; Мы поможем в написании вашей работы!