
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
F f f f f
|
|
|
|
Учитывая изложенное рассмотрим электронную структуру элементов периодической системы.
1 период. K -слой представлен одной s -орбиталью.
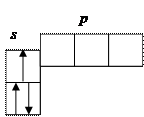
Водород Н (1 s 1) единственный электрон находится на самом низком из возможных энергетических уровней.
Гелий He (1 s 2) K- слой полностью застроен, завершает построение первого периода системы элементов.
2 период. Во внешнем L -слое имеются s и p -орбитали, на которых может разместиться 8 электронов.
 | |||
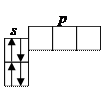 | |||
Литий Li (1 s 22 s 1) Бериллий Be (1 s 22 s 2)
2 2 2
1 1 1
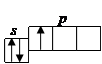 | 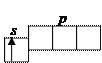 | ||

 Бор (1 s 22 s 22 p 1 Углерод C
Бор (1 s 22 s 22 p 1 Углерод C
 2 2
2 2
Аналогично застраиваются электронные орбитали азота N, кислорода O, фтора F. У неона Ne L -слой окончательно застраивается.
3 период. В третьем периоде порядок заполнения s и p -орбиталей нового M -слоя аналогичен рассмотренному во втором периоде. В отличие от L -слоя M -слой имеет d -орбитали. Однако в третьем периоде они не заполняются, поскольку раньше в соответствие правилу Клечковского должен быть заполнен 4 s подуровень, который заполняется в 4-м периоде. Во 2-м и 3-м периодах наружный слой заполняется до 8 электронов.
4 период. Заполняется 4 s -орбиталь, затем заполняются 3 d -орбитали предшествующего M -слоя и 4 p -орбитали N -слоя. При заполнении d -подуровня у хрома и меди имеет место так называемый провал или проскок электрона, заключающийся в том, что d -подуровень пополняется сразу двумя электронами, одним очередным и другим, захваченным с s -подуровня.
5 период. Этот период, как и четвертый, содержит два s -, десять d - и шесть p -элементов. Слои заполняются электронами в той же последовательности, что и у атомов элементов 4-го периода. Различие только в том, что появляется новый O -слой, являющийся наружным, а N -слой становится предшествующим. Порядок заполнения соответствует формуле: 5 s2 4 d 105 p 6. Имеет место большее количество электронных проскоков (провалов), чем в 4-м периоде. Электронные проскоки при заполнении d -подуровня наблюдаются для ниобия, молибдена, рутения, родия, серебра и палладия (двойной проскок). N -слой не застроен до конца за счет электронов f -подуровня. Согласно правилу Клечковского f -подуровень застраивается в 6 периоде. Завершается период инертным газом ксеноном.
6 период. Заполняется 6 s -орбиталь, затем заполняется один электрон на 5 d -подуровне, затем заполняется 4 f -подуровень четырнадцатью электронами. Эти 14 элементов от церия до лютеция принадлежат к элементам f -семейства и имеют практически одинаковые два наружных слоя (n= 5 и n =6). Эти элементы известны под названием лантаноидов, все они являются металлами и близки друг к другу по свойствам. После заполнения 4 f -подуровня продолжает заполняться оставшимися 9 электронами 5 d -подуровень и последним заполняется подуровень 6 p наружного P -слоя. У f -элементов имеют место проскоки электронов, однако они осуществляются не с наружного слоя на предшествующий, а со второго снаружи слоя на третий (элементы церий и тербий). У d -элементов 6 периода проскоки имеют место у платины и золота.
7 период. Этот период не закончен и содержит 20 элементов, вписанных в таблицу. В нем отсутствуют элементы конца периода. Последовательность заполнения электронами слоев аналогична 6 периоду.
В любом из рассмотренных периодов, за исключением первого, наружный слой последовательно заполняется от 1 до 8 электронов. В первом периоде наружный слой заполняется двумя электронами. Следовательно в каждом периоде сохраняется принцип периодичности заполнения электронами наружного слоя.
Периодическое повторение конфигурации ns 1 →ns 2 np 6 наружного слоя обусловливает периодическую изменяемость химических и физических свойств элементов и их соединений.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 784; Нарушение авторских прав?; Мы поможем в написании вашей работы!