
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение сплавов
|
|
|
|
Сплав – вещество полученное сплавлением двух или более элементов.
Строение сплава более сложное, чем чистого металла и зависит от того, в какие взаимодействия вступают компоненты, составляющие сплав.
Виды взаимодействий в сплавах:
1. Механическая смесь. Компоненты не вступают в химическую реакцию и не способны к растворению. На микроструктуре видны сплавленные между собой кристаллы компонента А и компонента Б. Химический анализ покажет 2 химических Элемента. Рентгенограмма покажет решетки двух компонентов А и Б.
2. Химическое соединение. Соотношение чисел атомов соответствует простой формуле в общем виде Аn Bm. Кристаллическая решетка совершенно отличная от решеток компонентов. Другая температура плавления.
3. Твердый раствор на основе одного компонента. Это большинство сплавов.
4. Твердый раствор на основе химического соединения.
5.Упорядоченные твердые растворы.
6. Электронные соединения.
7. Фазы Лавеса.
8. Фазы внедрения.
1.7 Энергетические условия процесса кристаллизации
В природе все самопроизвольно протекающие превращения, в том числе кристаллизация и плавление, обусловлены тем, что новое состояние является энергетически выгодным, то есть обладает меньшим запасом энергии.
Нарисуем пример со стальным шариком.

Шарик стремится из положения 1 попасть в положение 2, так как потенциальная энергия в положении 2 меньше.
Этот пример для шарика – то есть одной частицы, а для системы из множества частиц, (например, атомов в металле), введено понятие свободная энергия.
Свободная энергия системы – особая термодинамическая функция, описывающая энергетическое состояние системы частиц, охваченных тепловым движением (например, атомов в металле).
Запишем. Чем больше свободная энергия системы, тем она менее устойчива и будет стремиться перейти в состояние с меньшей свободной энергией.
Запишем. С изменением температуры свободная энергия изменяется, причем для жидкого и твердого состояния по-разному.
Нарисуем график.

Из графика видно, что выше температуры Тs вещество должно находится в жидком состоянии, а ниже Тs в твердом кристаллическом.
Что здесь Важно. Запишем. Тs – равновесная или теоретическая температура кристаллизации. При температуре Тs свободные энергии жидкого и твердого состояния равны. Кристаллизация происходить не может. Для ее начала необходимо некоторое переохлаждение.
Нарисуем на графике точку Тп. При этом уже имеется некоторая разница свободных энергий, то есть термодинамический стимул для начала кристаллизации.
Тп- фактическая температура кристаллизации.
Запишем определение. Степень переохлаждения – разность между теоретической и фактческой температурой кристаллизации.
Пример. Сурьма. Теоретическая температура – 631 градус, но до начала кристаллизации ее переохладили до 590. Значит степень переохлаждения 631-590 = 41 градус.
Соответственно при расплавлении твердого в жидкое состояние существуют понятия: перенагревание и степень перенагревания.
Рассмотрим кривые охлаждения при кристаллизации.
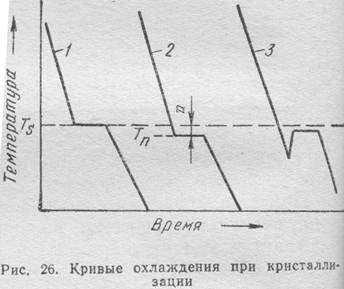
Нарисуем несколько графиков в координатах температура – время.
Первый пример - плавное понижение температуры - это охлаждение вещества в котором в данном интервале температур нет фазовых переходов.
Но нас интересует именно такие вещества, которые в данном температурном интервале кристаллизуются. Это может быть, например, металл или вода.
Запишем. Особенностью кристаллизации является появление горизонтальной площадки на кривой охлаждения.
Что происходит в это время. Начинают выпадать первые кристаллы, их кол- во увеличивается, раствор представляет собой своеобразную кашу в которой половину составляет твердое, половина жидкое.
Запишем. Процесс кристаллизации идет при постоянной температуре и до тех пор, пока не закристаллизуется последняя капля жидкости.
Почему не изменяется температура.? Потому что отвод тепла компенсируется скрытой теплотой кристаллизации. Это теоретическая кривая.
Нарисуем второй график. Мы уже говорили о фактической температуре плавления, которая ниже теоретической. Следовательно, необходимо некоторое переохлаждение величиной n что бы процесс начался.
Это реальная кривая охлаждения.
Нарисуем, какой бывает вариант реальной кривой. Например, у сурьмы при переохлажении ниже температуры кристаллизации происходит такой интенсивный выброс скрытой теплоты плавления, что температура скачкообразно повышается, приближаясь к теоретической.
1.8 Механизм процесса кристаллизации.
Процесс кристаллизации можно разделить на 2 элементарных процесса.
1. Зарождение мельчайших кристаллов.
2. Рост кристаллов из этих центров.
Для наглядности нарисуем модель кристаллизации, которая длится 7 секунд по 1 на каждую секунду.
Нам понадобится 7 квадратиков.
В первую секунду образовалось 5 зародышей.
Во вторую образовалось еще 5 и старые 5 выросли
И так далее.
Причем где-то в середине (секунды с 3-4) мы будем наблюдать, что выросшие кристаллы кое-где соприкасаются.

Нарисуем кинетическую кривую кристаллизации.

Запишем два важных момента.
1. Вначале процесс ускоряется, участвует все больше кристаллов. Но где-то в середине взаимное столкновение кристаллов начинает препятствовать их росту. И процесс замедляется, тем более, что жидкости в которой образовались новые кристаллы становится все меньше.
2. Пока кристалл окружен жидкостью, он имеет правильную форму. При столкновении и срастании кристаллов правильная форма нарушается. Поэтому реальные кристаллы не имеют правильной формы.
Запишем обозначения:
Ч.ц. – число центров кристаллизации, зарождающихся в каком то объеме в единицу времени. Размерность: Единица, деленная на мм 3 на сек (ТО ЕСТЬ число центров, возникших в 1 кубическом миллиметре за 1 секунду).
С к. – скорость кристаллизации – скорость роста кристаллов. Измеряется мм/мин.
Оба показателя зависят от степени переохлаждения.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 360; Нарушение авторских прав?; Мы поможем в написании вашей работы!