
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства топлив, используемых в жизненных циклах объектов транспорта
|
|
|
|
Понятие о горении углеводородных топлив. Материальные балансы. Механизмы горения
Для определения количественных показателей образования и потреблениявсех веществ, участвующих в процессе получения энергии сжигания топлива и из окружающей среды, используются уравнения материального баланса топлив.
Основным источником теплоты при сгорании топлив является окисление содержащихся атомов углерода С и водорода Н. Кроме того, в топливах могут содержаться в незначительном количестве сера, соединения азота, кислородсодержащие соединения (спирты, эфиры и др.), тяжелые металлы (табл. 1).
Таблица 1
| Топливо | Элементный состав, % (по массе) | l0 | Hu | ||||
| wc | wH | w0 | wN | ws | |||
| Водород Сжатый природный газ Сжиженный нефтяной газ Метанол СН3ОН Диметилэфир СН3ОСН3 Бензин Дизтопливо Мазут Каменный уголь | - 71,0 84,0 37,5 52,2 85,5 86,5 85,6 80,5 | 23,2 16,0 12,5 13,0 14,5 13,3 11,3 6,0 | - 0,4 - 50,0 34,8 - - 0,5 11,5 | - 5,3 - - - - 0,02 0,3 1,5 | - 0,1 0,01 - - 0,02 0,2 2,3 0, 5 | 34,34 13,63 15,1 6,5 9,0 14,8 14,5 13,8 10,8 | 119,6 46,9 45,5 19,6 28,8 44,0 41,3 40,9 32,3 |
Условная «молекула» имеет вид СхНуОz: (для азотсодержащих топлив — СхНуОzNg, для серосодержащих СxНyОzNgSk).
Материальный баланс формируется по элементному составу топлива, выражающему относительное массовое содержание отдельных элементов при полном и неполном сгорании топлива. Рабочая масса топлива, содержащего примеси азота, серы, золы, влаги, определяется по формуле:
wc+wH+w0+wN+ws+wA+ww=1 (8)
Для приведенных в табл. 1 топлив содержание в мазуте и каменном угле золы (А) и влаги (У) доходит соответственно до 0,2 и 9 % (мазут малосернистый), 10-40 и 4—15% (каменный уголь).
Массовые доли w отдельных элементов в 1 кг топлива СхНyОz находят по известным соотношениям:
Wc=12x/(12х+y+16z)=12x/MT (9)
Wн=у/(12х+у+16z)=e/MT (10)
W0=16z/(12x+y+16z)=16z/MT (11)
где MT - молярная масса «условной» молекулы топлива; 12х, у, 16z - масса углерода, водорода, кислорода в молекуле топлива; wc+wH+w0=1.
В большинстве товарных сортов бензина и дизельных топлив наличием кислорода можно пренебречь (условная «молекула» топлива СхНу, MT=12х+у).
Смесь газовых топлив состава ∑СхНуОz+N2 с объемной (молярной) долей каждого газа (φ) имеет следующий элементный состав для 1 кмоль (1 м3):
молярная масса смеси газов
 (12)
(12)
и массовые доли газов
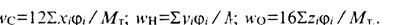 (13)
(13)
Полное окисление топлива. Соотношение между количеством исходных продуктов (топливо плюс воздух) и продуктов сгорания определяется из уравнений химической реакции при следующих допущениях: все химические соединения состоят из атомов отдельных элементов, связанных между собой в определенных числовых соотношениях; при химических реакциях атомы сохраняют свою индивидуальность и происходит только их перегруппировка. Полное окисление (сгорание) молекулы СхНу до конечных продуктов (диоксида углерода СО2 и водяного пара Н2О) описывается уравнением (исходные и конечные продукты реакции даны в киломолях)
 (2.14)
(2.14)
атомов С в 1 кмоль СхНу дают х кмоль С02, Nсо2=x;
у атомов Н в 1 кмоль СxНy> дают y/ 2 кмоль Н20, NН2О=y/2.
Состав продуктов сгорания в пересчете на 1 кг топлива (1/МT кмоль)
будет:

и через элементный состав с учетом уравнений (9)—(11)
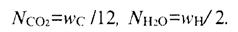
В реакции участвует х+у /4 кмоль 02, N02=х+у/4.
Если в состав топлива входит кислород (СxНуОz), то правая часть уравнения (14) останется неизменной, а необходимое для сгоранияколичество кислорода воздуха (кмоль) уменьшается соответственно на z:/2, Nо2=х+у/4—z/2. Количество кислорода (кмоль), необходимое для полного сгорания топлива и определяемое на основании уравнения (14), называют стехиометрическими.
Стехиометрическое количество N02 равно:
количество (кмоль) 02 на 1 кмоль топлива:

количество (кмоль) 02 на 1 кг топлива:
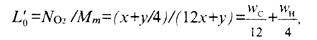
масса (кг) 02 на 1 кг топлива:
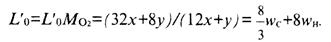
Теплота сгорания топлива Нu (МДж/кг топлива), т. е. тепловой
эффект реакций, идущих с образованием СО2 и Н20, определяется по формуле Д. И. Менделеева
 (15)
(15)
Масса кислорода, потребляемая из атмосферы для полного сгорания топлива (кг/кг топлива),
 (16)
(16)
где l0— стехиометрическое число. Принимая объемную долю кислорода в воздухе 21 % и массовую 23,2%, найдем стехиометрическое количество воздуха, необходимое для полного сгорания топлива:
количество (кмоль) воздуха на 1 кг топлива:
Lo=Ló/0,21=1/0,21(x+y/4)/(12x+y)=1/0,21(Wc/12+WH/4),
масса (кг) воздуха на 1 кг топлива:
l0=l0́/0,232=138(x+y/4)(12x+y)=138(Wc/12+WH/4).
Для газовых топлив, представляющих смесь углеводородов cсостава СхНуОz с объемной долей φi углеводорода, Lo 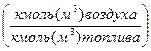 :
:
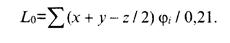 (17)
(17)
В формуле (2.16) α - коэффициент избытка воздуха - отношение количества воздуха, содержащегося в топливовоздушной смеси Gв к его минимальному количеству, которое теоретически необходимо для полного сгорания всего находящегося в ней топлива GТ:
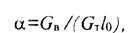 (18)
(18)
где GТ - часовой расход топлива, кг/ч; GТl0 - минимальное, теоретически необходимое для полного сгорания топлива количество воздуха, кг/ч. Если α=1, то смесь стехиометрического (теоретического) состава; α>1,0, — смесь бедная; α<1,0, - смесь богатая. Для дизелей α=1,4-2,2 (номинальный режим) и 4-5 - холостой ход, карбюраторных ДВС α=0,8—1,2.
В табл. 2 приведены данные о потреблении кислорода и выделении диоксида углерода, паров воды в результате полного сгорания топлив.
Таблица 2
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 749; Нарушение авторских прав?; Мы поможем в написании вашей работы!