
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Степень окисления – это условный заряд атома в молекуле, вычисленный согласно предположению о том, что молекула состоит из ионов
|
|
|
|
В.Г. Белинский – теоретик и организатор русской демократической журналистики.
А.С. Пушкин – редактор и журналист.
Народническая публицистика Г. Успенского.
Особенности публицистики В.Г. Короленко.
Короленко В.Г. Бытовое явление, Сорочинская трагедия (Открытое письмо статскому советнику Филонову) // Короленко В.Г. Собр. соч.: В 10 т. – М., 1955. – Т.9.
- Короленко В.Г. Павловские очерки. В голодный год (Вместо предисловия, гл. 1.) Мултанское жертвоприношение // Там же. Т. 9 – С.7-11, 21-27, 100-111, 344-351.
- Есин Б.И. История русской журналистики Х1Х в. – М.: Аспект Пресс, 2003.
Принято обозначать степень окисления римской цифрой с указанием: (+), (-).
Практическое значение окислительно – восстановительных реакций очень велико. Они лежат в основе многих таких важных промышленных процессов, как производство металлов, аммиака, серной и азотной кислот, широко используется в аналитической химии (во многих методах анализа).
1.Окислением называется процесс отдачи 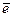 атомом, молекулой или ионом. (пи этом степень окисления повышается). Вещество, участвующее в окислении, называется восстановителем.
атомом, молекулой или ионом. (пи этом степень окисления повышается). Вещество, участвующее в окислении, называется восстановителем.
Al0 - 3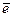 → Al3+ Fe2+ -
→ Al3+ Fe2+ - 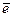 = Fe3+
= Fe3+
H2 - 2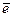 = 2H+ 2Cl- - 2
= 2H+ 2Cl- - 2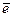 = Cl2
= Cl2
2. Восстановлением называется процесс присоединения 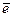 атомом, молекулой или ионом (С.О. при этом понижается). Вещество, участвующее в восстановлении, называется окислителем.
атомом, молекулой или ионом (С.О. при этом понижается). Вещество, участвующее в восстановлении, называется окислителем.
S0 + 2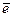 = S2-
= S2-
Cl2 + 2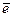 → 2Cl-
→ 2Cl-
Окисление и восстановление – взаимосвязанные процессы, так как вещества могут отдавать электроны только в том случае, если в реакции участвует другое вещество, способное электроны принимать, что определяет закон сохранения заряда в химических реакциях.
Окислителями являются:
1. Все атомы неметаллов. Окислительные свойства могут проявлять как простые, так и сложные вещества. К типичным (сильным) окислителям относятся галогены (фтор, хлор и др.), кислород, а также КС1О3, НС1О3, НNО3, Н2SО4 (конц.), МпО2, КMпО4, К2Сг2О7, РbО2 и др.
Восстановителями являются:
1. Атомы всех элементов, кроме He, Ne, Ar, F. Наиболее легко теряют электроны атомы тех элементов, которые на последнем слое имеют один, два, три электрона.
2. Положительно заряженные ионы металлов, находящиеся в низкой степени окисления, например:
Fe+2, Cr+3, Mn+2, Sn+2, Cu+1.
3. Отрицательно заряженные ионы, например Cl-, Br-, I-, S-2.
4. Слабые кислоты и их соли, например: H2SO3, K2SO3, HNO2 и KNO2
Составление уравнений окислительно – восстановительных реакций.
Составляя уравнение окислительно – восстановительной реакции следует сначала установить функции реагентов (окислитель, восстановитель, среду). Подбор коэффициентов в уравнении основан на том, что в результате реакции происходит перераспределение зарядов. Число электронов, отданных восстановителем, равно числу электронов, принятых окислителем.
Для подбора коэффициентов в уравнениях реакций окисления – восстановления используют метод электронного баланса.
Метод электронного баланса.
Последовательность составления окислительно-восстановительной реакции складываются из следующих этапов:
Записывают формулы реагентов и продукты реакции, находят элементы, повышающие и понижающие свои степени окисления и восстановления, и выписывают их отдельно, например:
МпСО3 + КС1О3 → МпО2 + КС1 + СО2
С1 5+ → С1-1
Мп+2 → Мп+4
С1+5… + 6е = С1-1 1
Мп+2 – 2е = Мп+4 3
По найденным множителям определяют стехиометрические коэффициенты для уравнения реакции (коэффициент 1 опускается, но подразумевается):
3МпСО3 + КС1О3 = 3МпО2 + КС1 + СО2
Уравнивают числа атомов элементов, не изменивших своих степеней окисления. Получают уравнение окислительно-восстановительной реакции:
3МпСО3 + КС1О3 = 3 МпО2 + КС1 + 3 СО2
Рассмотрим этот же приём для реакции:
K+2Cr+62O72- + 7H2+S+6O2+4+ 3K+2S2-→ 4K+2S6-O2-4+ Cr23+(S6+O2-4)3+ 3S0+ 7H+2O2-
 Cr6+- 3
Cr6+- 3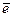 → Cr3+ 2 –
→ Cr3+ 2 –
S2- + 2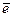 → S0 3 –
→ S0 3 –
10Fe2+S6+O2-4 +2K+Mn+7O4 +8H2SO4 → 5Fe+32(SO4)3 +2Mn+2SO4 +K2SO4 + 8H2O
 Mn+7 + 5
Mn+7 + 5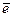 → Mn+2 2
→ Mn+2 2
2I- - 2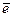 → I20 5
→ I20 5
Для того, чтобы определить степени окисления элементов в окислительно-восстановительной реакции, необходимо иметь ввиду:
Постоянную степень окисления имеют:
.1. Щелочные металлы - (+1)
2. щелочно-земельные - (+2)
3. галогены (ионы) - (-1)
4. водород в соединениях - (+1), исключения: гидриды
металлов КН, СаН2 (-1)
5. кислород О (-2), исключения: перекисные соединения Н2О2N,а2О2, - (-1),
ДОМАШНЕЕ ЗАДАНИЕ:
1. Контрольные вопросы:
1.1. Какие реакции относят к окислительно-восстановительным?
1.2. Что такое окисление? Привести примеры.
1.3 Что такое восстановление? Привести примеры.
1.4 Как изменяется степень окисления элементов при окислении и восстановлении? Привести примеры.
1.5 Что такое степень окисления?
2. Определить степень окисления каждого элемента в соединениях:
К2Сг2О7; КмпО4; К2МпО4; А12 (SО4)3; Си SО4 К2 S
ЛИТЕРАТУРА
4. Ищенко А.А. Аналитическая химия.М.»Академия». 2008.
5. Барсукова З.А. Аналитическая химия.М.Иысш.шк.,1989.
6. Лурье Ю.Ю. Справочник по аналитической химии. М. Химия.1985.
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 787; Нарушение авторских прав?; Мы поможем в написании вашей работы!