
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дополнение к теме: Квантовая теория строения атома
|
|
|
|
Механику, основанную на законах Ньютона, используют для объяснения свойств макрочастиц. Механику называют классической механикой. Свойства макрочастиц видны невооруженным взглядом. Она не пригодна для объяснения микрочастиц.
Квантовая механика отличается от классической тем, что:
1. Классическая механика основана на законах, утверждающих беспрерывное изменение свойств объектов. Классическая механика считает, что все существующее и происходящее в окружающей среде, является дискретным (прерывистым).
Впервые положение о дискретности сформулировал Планк в 1900г. Он считал, что процесс излучения атомами световой энергии происходит не беспрерывно, а порциями, величина которых зависит от частоты излучения:
 hν
hν
В классической механике различают понятие «частичка» и «волна».
Свойства частичек описывают их массой m, скоростью движения v, импульсом p.
Волновое движение характеризуют длиной волны λ, частотой излучения υ, амплитудой колебаний φ ().
2. Квантовая механика считает, что микрообъекты имеют корпускулярно-волновые свойства.
Это можно доказать следующим образом:
Выражение для энергии в уравнении Эйнштейна
E = mc2,
где m – масса тела; Е – его энергия, с – скорость света в вакууме ~ 300000 км/с.
Приравнять к выражению энергии в уравнении Планка:
 hν
hν
получаем mc2 = hν
Длина волны связана с частотой соотношением
λν ν =
ν =  , тогда
, тогда  и
и 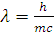 (Уравнение де Бройля).
(Уравнение де Бройля).
h=6,62∙10-34 Дж∙с
Приведенная зависимость длины волны от массы частицы подтверждает, что фотон проявляет одновременно свойства частички и волны.
Электрон, как всякая микрочастичка, проявляет корпускулярно-волновую двойственность.
Электрон в атоме не движется по определенным траекториям, а может находиться в любой части околоядерного пространства.
Пространство вокруг ядра, в котором наиболее велика вероятность нахождения электрона, называют орбиталью.
Электроны в атоме располагаются на разном расстоянии от ядра, формируя электронные уровни, которые распадаются на подуровни, имеющие орбитали разной формы (s- сферическая, p- форма гантели, d-, f- в форме цветка).
Состояние электрона в атоме характеризуется набором 5-ти (4-х) квантовых чисел.
1. n – главное квантовое число; имеет значения (1,2,3….). Определяет общую энергию электрона на данной орбитали.
n может обозначаться буквами: 1- K; 2-I; 3-M; 4-N; 5-O; 6-P; 7-Q.
Номер главного квантового числа совпадает с номером периода.
n – позволяет рассчитать предельное число электронов на энергетических уровнях (в периоде).
 ; число электронов
; число электронов
1 период; n = 1; 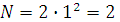 (He, H)
(He, H)
2 период; n = 2; 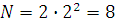
4 период n = 4; 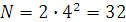
Уровень, на котором находится максимальное число электронов, называется завершенным.
2. l – орбитальное (азимутальное, побочное) квантовое число.
Имеет значение от 0 до n – 1
(1,2,3….. n – 1);
1 период: l = 1 – 1 = 0; n = 1
2 период: l = 2 – 1 = 1; n = 2
3 период: l = 3 – 1 = 2; n = 3
4 период: l = 4 – 1 = 3; n = 4
l – определяет форму атомной орбитали.
См.рис
3. Магнитное квантовое число 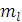
Имеет любые целые числа, как положительные, так и отрицательные или 0. Определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. 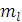 связано с l, изменяясь от + l до – l. Каждому значению l соответствует 2 l + 1 значений магнитного квантового числа.
связано с l, изменяясь от + l до – l. Каждому значению l соответствует 2 l + 1 значений магнитного квантового числа.

 4.
4.  - проекция спина (магнитное спиновое число) принимает только два значения: и
- проекция спина (магнитное спиновое число) принимает только два значения: и

5.  S – спиновое квантовое число. Спин – величина постоянная. Квантовое свойство электрона, не связанное с движением электрона в пространстве.
S – спиновое квантовое число. Спин – величина постоянная. Квантовое свойство электрона, не связанное с движением электрона в пространстве.
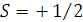

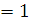


Правила заполнения орбиталей.
Подобно любой системе, атомы стремятся к минимуму энергии.
Это достигается при определенном состоянии электронов, т.е. при определенном распределении электронов по орбиталям.
Следует учитывать следующие закономерности:
1. Принцип Паули: в атоме не может быть электронов с одинаковым значением всех 4-х квантовых чисел. Т.е. на одной орбитали не может находиться более двух электронов. Максимальное число электронов на подуровнях составляет:
 ,
,  ,
,  ,
,  .
.
2. Принцип наименьшей энергии: наиболее устойчивому состоянию электрона в атоме соответствует минимальная энергия. Т.е. электрон стремиться занять орбиталь с наименьшей энергией. Принцип справедлив только для основных состояний.
3. Правило Хунда: электроны располагаются на одинаковых орбиталях таким образом, чтобы суммарный спин был максимальным.
4. Правило Клечковского: электрон в атоме занимает уровень с наименьшим значением . При одинаковых значениях сумма
. При одинаковых значениях сумма заполняется орбиталь с минимальным значением
заполняется орбиталь с минимальным значением .
.

| |
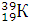 1S2 2S2 2ρ6 3S2 3ρ6 3d0 4S1 1S2 2S2 2ρ6 3S2 3ρ6 3d0 4S1
| 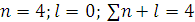

|
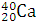 1S2 2S2 2ρ6 3S2 3ρ6 3d0 4S2 1S2 2S2 2ρ6 3S2 3ρ6 3d0 4S2
| 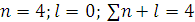

|
 1S2 2S2 2ρ6 3S2 3ρ6 3d1 4S2 1S2 2S2 2ρ6 3S2 3ρ6 3d1 4S2
| 



|
Понятие об 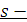 ,
,  электронах и их распределении по энергетическим уровням. Электронные формулы.
электронах и их распределении по энергетическим уровням. Электронные формулы.
Структуру электронных оболочек можно изобразить с помощью электронных или квантовых, ячеек – так называемых графических электронных формул.
Каждая ячейка обозначается клеткой. Клетка – орбиталь, стрелка – направление спина; свободная клетка – свободная орбиталь, которую может занимать электрон при возбуждении.
Примеры: Рис.



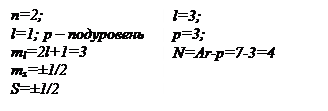 |

|
|
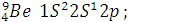
Проскок электронов: с 4s на 3d – подуровень:
наблюдается у некоторых  ;
; 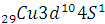 ;
;
d- элементов с незавершенным с 5s на 4d – подуровень:
d- подуровнем. Или 
у 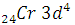 стремится к более
стремится к более 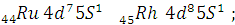
устойчивому - 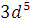 .
.  (двойной проскок)
(двойной проскок)


с 6s на 5d – подуровень:

Последовательность заполнения энергетических уровней и подуровней.

Характеристика составных частей атома.
| Название | Символ | Относительная масса | Заряд | Количество в атоме | |
| Ядро | Протон | 
| +1 | Z (порядковый номер) | |
| Нейтрон | 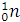
| N = Ar - Z | |||
| Электрон | 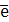
| 
| -1 | Z (порядковый номер) |
Протонное число равняется заряду ядра атома элемента.
Нуклонное число – это общее количество протонов и нейтронов в ядре.
Нуклид – это тип атомов с определенными значениями нуклонного и протонного чисел.
Изотопы – это разновидности атомов одного химического элемента, которые отличаются по массе вследствие различного содержания нейтронов в ядре.
Например, изотопы водорода:
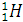 (Протий),
(Протий), 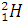 (Дейтерий – D);
(Дейтерий – D); 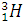 (Тритий – Т).
(Тритий – Т).
В настоящее время известно ~ 300 устойчивых изотопов и синтезировано больше 1800 неустойчивых радиоактивных изотопов.
Изобары – это атомы (нуклиды) разных химических элементов, которые имеют одинаковые массовые числа.
Например, массовое число 40 имеют атомы разных элементов: Аргона  Калия
Калия  , Кальция
, Кальция 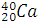 .
.
Изотоны – это ядра атомов химических элементов, которые имеют разное число протонов, но одинаковое число нейтронов.

Радиоактивность.
Устойчивость ядер характеризуются соотношением:
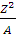 ,
,
Где Z – заряд ядра атома, А – его массовое число. Если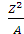
 , то ядро неустойчивое, радиоактивное. Неустойчивые ядра атомов, имеют нечетный атомный номер.
, то ядро неустойчивое, радиоактивное. Неустойчивые ядра атомов, имеют нечетный атомный номер.
Радиоактивность. Самопроизвольное превращение неустойчивых ядер атомов одного химического элемента в ядра атомов одного или нескольких других элементов, сопровождающееся излучением элементарных частиц и энергии, называется радиоактивностью.
Химические элементы, все изотопы которых радиоактивны, называются радиоактивными элементами.
Радиоактивность различают:
· естественную;
· искусственную.
Естественную радиоактивность проявляют изотопы элементов, существующие в природе.
Z = 84 – 92 не имеют ни одного стабильного изотопа.
Искусственную радиоактивность проявляют изотопы элементов, полученные в лаборатории вследствие ядерных реакций. (Начало работ 1943г. Ф.Ж. Кюри и Ирэн Кюри).
Z = 43 (технеций), Z = 85 (астат), Z = 93 -110 (трансурановые элементы), получены искусственно. Они имеют лишь радиоактивные изотопы.
Устойчивость радиоактивного изотопа характеризуют периодом полученияраспада, то есть промежутком времени, на протяжении которого распадается половина начального количества данного радиоактивного изотопа. Период полураспада обозначают  ,
, 
 .
.

Где  исходное количество радиоактивных атомов,
исходное количество радиоактивных атомов, количество оставшихся атомов к моменту времени
количество оставшихся атомов к моменту времени  (
(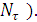
Примеры:
 -
-  80000,
80000,

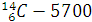
Радиоактивный распад относится к реакциям 1-го порядка.
Виды радиоактивного распада:
·  Излучение – поток ядер гелия, движутся с большой скоростью.
Излучение – поток ядер гелия, движутся с большой скоростью.
· 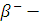 Излучение – поток электронов, движутся со скоростью света.
Излучение – поток электронов, движутся со скоростью света.
·  Излучение – поток позитронов – частиц, имеющих положительные заряды, движутся как электроны.
Излучение – поток позитронов – частиц, имеющих положительные заряды, движутся как электроны.
·  Излучение – электромагнитные волны с большой проникающей способностью и высокой энергией.
Излучение – электромагнитные волны с большой проникающей способностью и высокой энергией.
Примеры:
 - распад ядер
- распад ядер
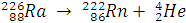
Образовался элемент, расположенный в ПСЭ на две группы левее.
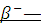 распад ядер
распад ядер
 .
.
Элемент расположен в соседней справа группе ПС.
 распад ядер
распад ядер

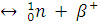
Протон превращается в нейтрон.
Образовался элемент, расположенный в ПС левее на одну группу
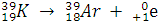 или
или 
Уменьшение заряда ядра на единицу может быть вызвано не только
 распадом, но и электронным захватом.
распадом, но и электронным захватом.
Пример:
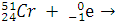
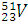
Электрон поглощается ядром. (Такой ядерный процесс называется К-захватом – электрон находится в К-электронном слое.)
|
|

Типические элементы – это элементы 2-го и 3-го периодов, по которым наиболее наглядно проследить смену свойств элементов и их соединений.
 |  |  |
Много свойств элементов изменяются периодически. К ним относятся:
· Атомный радиус; характеризует межатомное (межядерное) расстояние между одинаковых атомов в молекуле или кристалле.
· Энергия ионизации (I) – это энергия, необходимая для отрыва электрона от невозбужденного атома; измеряется в электрон-вольтах (ЭВ); 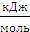 . Наименьшее напряжение поля, при котором происходит ионизация атомов, называют потенциал ионизации. Измеряется в вольтах. Для многоэлектронных атомов энергию отрыва 1-го электрона называют первым потенциалом ионизации.
. Наименьшее напряжение поля, при котором происходит ионизация атомов, называют потенциал ионизации. Измеряется в вольтах. Для многоэлектронных атомов энергию отрыва 1-го электрона называют первым потенциалом ионизации.
 так как образуется катион крепко удерживает оставшиеся электроны. Энергия ионизации зависит от заряда ядра атома, электронной конфигурации валентных электронов, расстояния электрона от ядра, числа внутренних электронных слоев, которые обусловливают эффекты экранирования и проникновение электрона к ядру. Чем меньше энергия ионизации, тем сильнее проявляются металлические и восстановительные свойства.
так как образуется катион крепко удерживает оставшиеся электроны. Энергия ионизации зависит от заряда ядра атома, электронной конфигурации валентных электронов, расстояния электрона от ядра, числа внутренних электронных слоев, которые обусловливают эффекты экранирования и проникновение электрона к ядру. Чем меньше энергия ионизации, тем сильнее проявляются металлические и восстановительные свойства.
Эффект экранирования заряда ядра обусловленный способностью внутренних электронных слоев ослаблять действие ядра на внешние электроны и уменьшать их связь с ядром. Эффект экранирования возрастает с увеличением электронных слоев.
· Энергия сродства к электрону (Е) – это энергия, которая выделяется или поглощается при присоединении электрона к нейтральному невозбужденному атому с образованием аниона.
Единица измерения – кДж/моль или ЭВ.
Сродство к электрону зависит от электронного строения атома: чем больше количество электронов во внешнем электронном слое и меньше радиус атома, тем больше сродство к электрону.
Наибольшее сродство к электрону имеют галогены, чем больше Е, к электрону, тем сильнее выражены неметаллические свойства. Сродство к электрону при возрастании атомного номера элемента изменяется периодически.
· Электроотрицательность – это способность атомов присоединять к себе валентные электроны. По Малликену  Чем больше
Чем больше  , тем сильнее неметаллические свойства.
, тем сильнее неметаллические свойства.
· Металлические свойства: характеризуют способность отдавать валентные электроны.
· Неметаллические свойства: характеризуют способность присоединять электроны до завершения уровня.
Периодический закон Д.И. Менделеева.
Закон периодичности (1869г.)
«Свойства элементов и их соединений состоят в периодической зависимости от их атомной массы».
Свойства простых тел, а также форма и свойства соединений элементов находятся в периодичной зависимости от величины атомного веса элементов.
В настоящее время периодический закон формулируется следующим образом:
«Свойства элементов, простых веществ и соединений элементов находятся в периодической зависимости от величины заряда ядер их атомов».
Периодический закон – один из фундаментальных законов природы, он является основой всей современной химической науки.
Периодическая система элементов – это графическое изображение периодического закона.
Например.
2-й период
Li Be B C N O F
Возрастает Z ядра
Li Be B,C,N,O,F
основные амфотерные кислотные свойства
свойства свойства
Восстановительные свойства убывают →
Окислительные свойства возрастают→
Валентность возрастает →
У простых веществ этих элементов слева направо в периодах усиливаются кислотные свойства и ослабевают основные, через амфотерные.
Li Li2O LiOH
основной оксид щелочь
Be BeO Be(OH)2 H2BeO2
амфотерный основание
оксид
B B2O3 --------- H3BO3
кислотный оксид борная кислота
C CO2 --------- H2CO3
кислотный оксид угольная кислота
N N2O5 -------- HNO3
кислотный оксид азотная кислота
F ------------- -------- HF
фтороводородная
кислота
Сила кислот увеличивается от Be к F→
Периодическая система химических элементов.
Существует более 500 вариантов графического построения ПСЭ.
Таблица состоит из 10 горизонтальных рядов и 8 вертикальных столбцов, называемых группами.
I, II, III периоды – малые периоды.
I период – два элемента (Hi,He)
II, III периоды – 8 элементов.
IV, V, VI, VII периоды – большие.
VII период – незавершенный.
IV, V, VI периоды состоят из 2-х рядов: четного и нечетного.
Четвертый период образуют 18 элементов (от К………Кr)
от калия до криптона
Пятый период – 18 элементов (от Rb………..Xe)
от рубидий до ксенон
Шестой период – 32 элемента (от цезия Cs до радона Ra).
Из 32 элементов 14 элементов – лантаноиды.
Седьмой период (десятый ряд элементов) содержит 21 элемент, из которых 14 – актиноиды.
Номер периода соответствует числу энергетических уровней атомов, заполняемых электронами.
В периодах:
· Радиус атома уменьшается слева направо, а при переходе от одного периода к другому – увеличивается;
· Заряд ядра увеличивается слева направо, электроны сильнее притягиваются к ядру и электронная оболочка как бы сжимается.
· В группах увеличивается число электронных оболочек и, соответственно, радиус атома.
В вертикальных столбцах таблицы – группах располагаются элементы, обладающие одинаковой валентностью в высших солеобразующих оксидах (указываются римской цифрой).
Каждая группа разделена на две подгруппы: главную и побочную.
Главная подгруппа (подгруппа А) включает элементы малых периодов и четных рядов больших периодов.
Побочная (подгруппа В) образована элементами нечетного ряда.
VIII группа состоит из 9 элементов, разделенных на триады сходных друг с другом элементов, и подгруппы инертных элементов.
У элементов главных подгрупп число электронов на внешнем уровне равно номеру группы.
У элементов побочных подгрупп на внешнем уровне 1-2 электрона.
Деление элементов на группы и подгруппы обусловлено порядком заполнения электронами уровней и подуровней:
· У элементов главных подгрупп электронами заполняют либо s-, либо p-подуровень внешнего уровня.
· У элементов побочных подгрупп – либо d-подуровень предвнешнего слоя, либо f-подуровень третьего снаружи слоя (лантаноиды и актиноиды).
У атомов элементы побочных подгрупп валентными являются электроны внешнего, но и предвнешнего уровня.
Максимальная валентность их равна номеру группы.
У элементов главных подгрупп при увеличении атомной массы наблюдается усиление металлических свойств и ослабление неметаллических.
Изменение свойств химических элементов в периодах и группах ПСЭ Д.И. Менделеева.
| Форма существования химического элемента и его свойства | Изменение свойств | ||
| В главных подгруппах | В периодах | ||
| Атомы | Заряд ядра | Увеличивается | Увеличивается |
| Число эл. уровней | Увеличивается | Не изменяется (равняется номеру периода) | |
| Число электронов на внешнем уровне | Не изменяется (равняется номеру группы) | Увеличивается | |
| Радиус атома | Увеличивается | Уменьшается | |
| Электроотрицательность | Уменьшается | Увеличивается | |
| Энергия ионизации | Уменьшается | Увеличивается | |
| Восстановительные свойства | Увеличиваются | Уменьшаются | |
| Окислительные свойства | Уменьшаются | Увеличиваются | |
| Высшая положит. | Постоянная | Увеличивается | |
| Степень окисления | Равняется номеру группы | От +1 до +8 | |
| Низшая степень окисл. | Не изменяется (равняется номеру групп) | Увеличивается от -4 до -1 | |
| Простые в-ва | Металлические св-ва | Усиливаются | Ослабевают |
| Неметаллические св-ва | Ослабевают | Усиливаются | |
| Соединения элементов | Характер химических свойств высшего оксида | Усиление основных и ослабевание кислотных св-в | Основной - амфотерный – кислотный. Усиление кислотных св-в и ослабевание основных св-в. |
| Характер химических св-в гидроксида, высшей степени окисления | Усиление основных и ослабевание кислотных св-в | Щелочь – основа – амфотерный гидроксид – кислота. Ослабление основных св-в и усиление кислотных св-в |
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 1256; Нарушение авторских прав?; Мы поможем в написании вашей работы!