
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диффузия и катализ
|
|
|
|
В том случае, когда наблюдаемые на опыте скорости каталитических процессов зависят от условий переноса вещества и тепла в газовой фазе или в порах катализатора, используют условный термин “макрокинетика“.
Другими словами, здесь изучают зависимость скоростей химических реакций от макрофакторов – неоднородностей концентраций реагентов и температуры в зоне реакций, зависящих от условий диффузии, конвекции и теплопередачи.
На опыте такие случаи отличаются по изменению скоростей реакций при изменении размера гранул катализатора, скорости газового потока и т.д.
Протекание химической реакции охватывает как химические процессы, так и физические процессы. Если процессы диффузии происходят быстрее, чем химические реакции, то диффузия не влияет на суммарную скорость процесса. При этом концентрации реагентов в порах и над внешней поверхностью катализатора соответствуют их концентрациям в газовой фазе.
Если же скорость диффузии сравнима со скоростью реакции, то последняя уменьшается вследствие неполноты массопереноса. В предельном случае скорость процесса может полностью определяться диффузией.
Различают два вида диффузии: диффузию к внешней поверхности зерен катализатора (внешняя диффузия) и диффузию в порах (внутренняя диффузия).
При изучении кинетики химической реакции влияние диффузии должно быть исключено.
Из общих соображений ясно, что можно выделить четыре предельных случая, когда при заданных значениях скорости транспорта и каталитического превращения будут наблюдаться различные закономерности.
1. Внешняя диффузионная область наблюдается в тех случаях, когда скорость диффузии реагентов даже к легко доступным участкам катализатора (наружной поверхности гранул или к стенке) меньше скорости реакции на этих участках. При этом кинетические закономерности определяются законами транспорта вещества к поверхности катализатора. Градиент концентрации реагентов в газовой фазе велик, а катализ осуществляется на внешней поверхности гранул.
2. Внутренняя кинетическая область наблюдается в тех случаях, когла скорость транспорта реагентов к самым труднодоступным участкам поверхности катализатора превышает скорость химической реакции. Явления диффузии не искажают кинетические закономерности, относящиеся к адсорбции или катализу. Эффективна вся поверхность катализатора. Градиенты концентраций реагентов в газовой фазе и порах катализатора невелики.
3. Внешняя кинетическая область отвечает тем случаям, когда скорость диффузии к внешней поверхности гранул достаточно велика по сравнению со скоростью реакции на поверхности гранул, а эта последняя, в свою очередь, так велика, что основная масса реагентов претерпевает превращение на внешней поверхности гранул катализатора. Кинетические закономерности не осложнены диффузионными. Эффективно работает только внешняя поверхность гранул катализатора. Градиенты концентрации реагентов в газовой фазе малы, но они велики в устье пор катализатора.
4. Внутренняя диффузионная область наблюдается тогда, когда скорости диффузии в порах катализатора соизмеримы со скоростью каталитического превращения на стенках пор. Концентрации веществ на внешней поверхности пористого катализатора близки к концентрациям в объеме. Концентрации в порах уменьшаются от наружной поверхности зерна к центру. При понижении температуры можно достичь перехода реакции из внутренней диффузионной области в кинетическую. Такой переход можно осуществить также за счет изменения пористой структуры катализатора с одинаковыми удельными каталитическими характеристиками.
Типичная форма зависимости логарифма константы скорости гетерогенного процесса от величины обратной температуры показана на рис. 9.
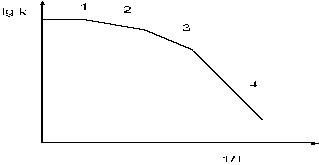
Рис.9. Зависимость логарифма кажущейся константы скорости от обратной температуры.
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 2022; Нарушение авторских прав?; Мы поможем в написании вашей работы!