
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Спектр атома водорода по Бору
|
|
|
|
Постулаты, выдвинутые Бором, позволили рассчитать спектр атома водорода и водородоподобных систем — систем, состоящих из ядра с зарядом Ze и одного электрона (например, ионы Не+, Li2+), а также теоретически вычислить постоянную Ридберга.
Следуя Бору, рассмотрим движение электрона в водородоподобной системе, ограничиваясь круговыми стационарными орбитами. центростремительное ускорение. Второй закон Ньютона для электрона, движущегося по окружности под действием кулоновской силы, имеет вид

Решая совместно уравнение
(16.1) и (16.2) получим выражение для радиуса n-й стационарной орбиты:
 (16.4)
(16.4)
где n=1, 2, 3,.... Из выражения (16.4) следует, что радиусы орбит растут пропорционально квадратам целых чисел.
Для атома водорода (Z=l) радиус первой орбиты электрона при n=1, называемый первым боровским радиусом (а), равен
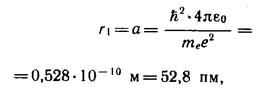 (16.5)
(16.5)
что соответствует расчетам на основании кинетической теории газов. Так как радиусы стационарных орбит измерить невозможно, то для проверки теории необходимо обратиться к таким величинам, которые могут быть измерены экспериментально.
Такой величиной является энергия, излучаемая и поглощаемая атомами водорода.
Полная энергия электрона в водородоподобной системе складывается из его кинетической энергии {meu2/2) и потенциальной энергии в электростатическом поле ядра  -
-

учли, что 
Учитывая квантованные для радиуса n-й стационарной орбиты значения получим, что энергия электрона может принимать только следующие дозволенные дискретные значения:
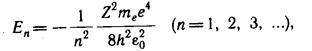 (16.5)
(16.5)
энергетические состояния атома образуют последовательность энергетических уровней, изменяющихся в зависимости от значения n. Целое число n в выражении 16.5, определяющее энергетические уровни атома, называется главным квантовым числом. Энергетическое состояние с n = 1 является основным (нормальным) состоянием; состояния с n> 1 являются возбужденными. Энергетический уровень, соответствующий основному состоянию атома, называется основным (нормальным) уровнем; все остальные уровни являются возбужденными. Придавая n различные целочисленные значения, получим для атома водорода

рис.16.1
(Z=l), согласно формуле (16.5), возможные уровни энергии, схематически представленные на рис16.1. Энергия атома водорода с увеличением n возрастает (уменьшается ее отрицательная величина) и энергетические уровни сближаются к границе, соответствующей значению n =¥. Атом водорода обладает, таким образом, минимальной энергией (E1= — 13,55 эВ) при n=1 и максимальной (E¥ =0) при n=¥ (при удалении электрона из атома). Следовательно, значение E¥ =0 соответствует ионизации атома (отрыву от него электрона). Согласно второму постулату Бора при переходе атома водорода (Z=l) из стационарного состояния n с большей энергией в стационарное состояние m с меньшей энергией испускается квант
 (16.6)
(16.6)
Откуда частота излучения
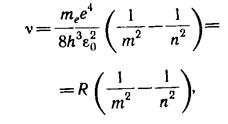 (16.7)
(16.7)
где
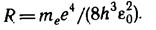
Воспользовавшись при вычислении R современными значениями универсальных постоянных, получим величину, совпадающую с экспериментальным значением постоянной Ридберга в эмпирических формулах для атома водорода (см. 13.1-13.5). Это совпадение убедительно доказывает правильность полученной Бором формулы (16.5) для энергетических уровней водородоподобной системы.
Теория Бора была крупным шагом в развитии атомной физики и явилась важным этапом в создании квантовой механики. Однако эта теория обладает внутренними противоречиями (с одной стороны, применяют законы классической физики, а с другой –основывается на квантовых постулатах). Она рассмотрела спектры атома водорода и водородоподобных систем и вычислила частоты спектральных линий, однако не смогла объяснить их интенсивности и ответить на вопрос: почему совершаются те или иные переходы? Серьезным недостатком теории Бора была невозможность описания с ее помощью спектра атома гелия- одного из простейших атомов, непосредственно следующего за атомом водорода.
Заключение
Эффект Комптона – это взаимодействие квантов света с частицами вещества. В результате образуется новый квант света с меньшей частотой. Наиболее ярко этот эффект проявляется при рассеянии рентгеновского излучения на свободных электронах, так как длина волны Комптона зависит от массы частицы, на которой происходит рассеяние, обратно пропорционально.
Гипотеза Луи-де-Бройля подтверждается экспериментально по дифракции электронов на кристаллической решетке. Следовательно, при рассмотрении элементарных частиц необходимо учитывать и их волновые свойства.
Любая модель атома должна удовлетворять следующим требованиям:
1. атом-электронейтрален;
2. Атом-устойчивая система
3. Спектр излучения атома должен быть линейчатым.
Элементарная теория атома по Бору работает только для атома водорода.
Ст. преподаватель кафедры___________________________
(наименование кафедры)
_______________________ ________________________
(ученая степень, ученое звание, подпись) (И.О.Ф.)
«____»________________г.
|
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 889; Нарушение авторских прав?; Мы поможем в написании вашей работы!