
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворимость веществ в воде
|
|
|
|
Тепловые явления при растворении
| Экзотермический процесс – растворение вещества сопровождается выделением теплоты (+Q кДж): серная кислота в воде | Эндотермический процесс – растворение вещества сопровождается поглощением теплоты (- Q кДж): нитрат калия в воде |
| Растворимость – это свойство веществ растворяться в воде или другом растворителе. |
| Хорошо растворимы в воде | Малорастворимы в воде | Нерастворимы в воде |
| CuSO4; C2H5OH; NH3; NaOH | PbSO4; BaSO4; N2; O2; (C2H5)2O - диэтиловый эфир | Стекло, Ag; Cu; керосин, благородные газы |
| Количественно растворимость выражается максимальным числом граммов вещества, которое можно растворить в 100 г. растворителя (или в 1 дм3) при данной температуре: S – коэффициент растворимости, [S] = г/100г Н2О или г/дм3 | ||||
| Растворимость зависит | ||||
| От природы вещества и растворителя: подобное растворяется в подобном | От температуры: с повышением температуры растворимость большинства твердых и жидких веществ повышается, а газообразных – понижается. | От давления – для газообразных веществ: при повышении давления растворимость повышается, при уменьшении – понижается. | ||
С пособы выражения состава растворов.
| Молярная концетрация, или молярность, - это величина, равная отношению количества растворенного вещества к объему раствора | |
| Раствор, в 1 дм3 которого содержится 1 моль растворенного вещества, называется молярным и обозначается буквой М 1 М NaOH – одномолярный раствор. 1 дм3 раствора содержит: 1 моль вещества или 1 моль . 40 г/моль = 40 г NaOH. | |
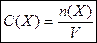
| C(X) – молярная концетрация частиц X, моль/дм3. |
| n(X) – количество вещества частиц Х, содержащихся в растворе, моль | |
| V – объем раствора, дм3. |
Примеры записи молярной концетрации
| C(HCl) = 0.1 моль/дм3 | С(H3PO4) = 0.5 моль/дм3 | С(H+) = 1 . 10 -5 моль/дм3 |
Массовая доля растворенного вещества 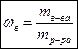 mв-ва – масса растворенного вещества
выражается в долях от «0» до «1». mр-ра – общая масса раствора
может быть выражена в процентах mв-ва – масса растворенного вещества
выражается в долях от «0» до «1». mр-ра – общая масса раствора
может быть выражена в процентах  mр-ра = mв-ва + mр-ля mр-ра = mв-ва + mр-ля
|
| Массовая доля показывает, сколько вещества (в г) содержится в растворе массой 100 г. |
Изменение содержания вещества в растворе (изменение w)
I. Увеличение массовой доли: 
| |
| растворение дополнительной порции вещества |  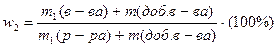 w1 < w2 w1 < w2
|
| упаривание раствора (удаление части растворителя) |   w1 < w2 w1 < w2
|
| смешивание с раствором того же вещества с большей массовой долей | 

 w1 < w3 < w2
w1 < w3 < w2
|
II. Уменьшение массовой доли: 
| |
| удаление порции вещества (осаждение или испарение) |   w1 > w2 w1 > w2
|
| добавление растворителя (разбавление) |  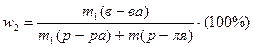 w1 > w2 w1 > w2
|
| смешивание с раствором того же вещества с меньшей массовой долей | 
 w1 < w3 < w2
w1 < w3 < w2
|
|
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 621; Нарушение авторских прав?; Мы поможем в написании вашей работы!