
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типы окислительно-восстановительных реакций
|
|
|
|
Типичные окислители и восстановители
Степень окисления
Под степенью окисления понимают условный электрический заряд,
который может получить атом, если все электроны, образующие с
ним химическую связь, будут полностью смещены к более
электроотрицательному элементу.
Положительная степень окисления равна числу электронов, отданных атомом элемента, а отрицательная – принятых: Na2+1S2−, Mg+2CI 21−.
Степень окисления – величина формальная. Например, в молекуле HI
атомы водорода и йода не обладают целочисленными зарядами, однако степень окисления водорода и йода в HI равны, соответственно, +1 и –1. Иными словами, степень окисления – условный заряд атома в молекуле, вычисленный исходя из предположения, что все связи между атомами ионные.
Не отражая истинного эффективного заряда атома в молекуле, степень
окисления не совпадает и с валентностью элемента (см. выше). Углерод является четырехвалентным элементом, однако проявляет разные степени
окисления. Так, степень окисления атома углерода +2 в муравьиной кислоте
НСООН, +1 в ацетальдегиде R–CОН и, наконец, 0 в таких соединениях, как
в CH2Cl2, H2C=O.
Степени окисления атомов являются условными величинами, однако
изменение их значений в ходе реакции однозначно указывает на изменение
распределения электронов одного и того же элемента, входящего в состав
исходных веществ и продуктов реакции, тем самым указывая на окислительно-восстановительный характер реакции.
Типичными окислителями являются:
– простые вещества элементов с достаточно высоким значением электроотрицательности (неметаллы): F 2, Cl 2, O 2, Br 2;
– сложные вещества, в состав которых входит элемент в высшей степени
окисления, способный только понижать ее, т. е. участвовать в процессе восстановления: азотная кислота HNO3, селеновая кислота H2SeO4, концентрированная серная кислота H2SO4, бихромат калия K2CrO4, перманганат калия KMnO4, диоксид свинца PbO2 и др.
К типичным восстановителям относятся:
– простые вещества элементов с низкой электроотрицательностью (металлы).
И, прежде всего, щелочные и щелочноземельные металлы,
– простые вещества – молекулярный водород (H2), углерод (С),
– сложные вещества, содержащие атомы элементов в низшей степени окисления – H2S, NH3, HI, KBr, KH.
Вещества, образованные элементами в промежуточных степенях окис-
ления, в зависимости от условий могут быть как окислителями, так и восстановителями: KNO2, SO2, KClO, H2O2.
Различают три основных типа окислительно-восстановительных реакций.
К реакциям межмолекулярного окисления-восстановления относят
реакции, в которых атом-окислитель и атом-восстановитель принадлежат к
разным веществам. Например,
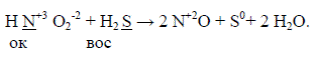
К реакциям диспропорционирования относят реакции, в которых функции окислителя и восстановителя выполняет один и тот же атом молекулы или иона, находящийся в промежуточной степени окисления. Например,
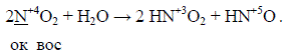
К реакциям внутримолекулярного окисления-восстановления относят реакции, в которых атом окислитель и атом восстановитель входят в состав одной и той же молекулы или одного и того же иона. Например,
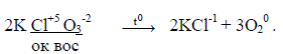
|
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 524; Нарушение авторских прав?; Мы поможем в написании вашей работы!