
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Специфические механизмы регуляции активности ферментов у микроорганизмов. Регуляция путей биосинтеза и промежуточного обмена
|
|
|
|
Регуляция анаболических путей метаболизма микробной клетки осуществляется аллостерически по механизму гетеротропной кооперативности. Мишенью ингибирования конечным продуктом (или продуктами) того или иного биосинтетического пути является фермент, осуществляющий первую реакцию данного пути. В этом случае ни конечный продукт ни интермедиаты, участвующие в его образовании, не могут накапливаться в клетке. Если это избыточное образование и накопление происходит, то в результате торможения первого фермента деятельность всей цепи замедляется.
 |
При посредстве такой регуляции скорость образования метаболических интермедиатов влияет на скорость функционирования катаболических путей. Благодаря этому контролируется первичная скорость поступления углерода во все биосинтетические последовательности реакций и общая скорость синтеза АТФ. Ферменты, играющие роль в конструктивном и энергетическом метаболизме (амфиболические ферменты), могут регулироваться одновременно с помощью гомотропропной и гетеротропной кооперативности.
Аллостерическая регуляция - один из типов регуляции активности фермента. Этот тип регуляции представляет собой эффект, наблюдаемый в тех случаях, когда небольшие молекулы (эффекторы), связываясь с ферментом не в области активного центра, изменяют скорость реакции. Подобная регуляция может быть гомотропной, когда молекула субстрата, взаимодействуя с ферментом, изменяет его сродство к молекулам того же субстрата, и гетеротропной, когда сродство к субстрату изменяется при взаимодействии фермента с молекулой, не похожей на молекулы субстрата. Гомотропные и гетеротропные эффекторы могут быть активаторами или ингибиторами.
Аллостерический активатор, действующий на фермент, описываемый симметричной моделью, будет связываться предпочтительно с R -конформером, стабилизируя это состояние. В результате активатор будет увеличивать начальную концентрацию R -конформеров по сравнению с концентрацией T -конформеров и, следовательно, увеличивать сродство фермента к своему субстрату (положительная кооперативность).
Аллостерический ингибитор, наоборот, предпочтительно связывает и стабилизирует фермент, находящийся в T -состоянии, вызывая таким образом уменьшение сродства фермента к своему субстрату (отрицательная кооперативность).
В целом роль аллостерических эффекторов заключается в том, чтобы либо расширить (в случае ингибитора), либо сузить (в случае активатора) диапазон концентраций субстрата, в котором фермент способен увеличивать скорость реакции.
Кроме того, отрицательное воздействие конечных продуктов может сочетаться с активацией фермента субстратом или его предшественником. Например, активность НАД+-зависимой изоцитратдегидрогеназы у Е. coli стимулируется АДФ и цитратом, но подавляется а-кетоглутаратом и глутаматом.
В разветвленных метаболических путях подавление активности фермента, катализирующего начальные стадии процесса, одним из конечных продуктов приводило бы к дефициту остальных конечных продуктов. Для особой организации регуляторных механизмов в таких путях существуют две основные возможности:
первая - образование нескольких аналогичных ферментов, катализирующих одну и ту же стадию процесса, но регулируемых избирательно только одним из конечных продуктов (изоферменты);
Примером такой реакции может служить синтез 2-ацетиллактат. Эта реакция, с одной стороны, участвует в анаэробном сбраживании глюкозы с образованием ацетоина (катаболизм); с другой стороны, с нее начинается путь синтеза валина (анаболизм). Таким образом, 2-ацетиллактат является общим промежуточным продуктом разветвленной цепи реакций.

Клетки могут синтезировать два изофункциональных фермента. Один из них образуется только в том случае, если во время брожения снизилось значение рН и конечным продуктом является нейтральный ацетоин. Другой фермент синтезируется в нейтральной и слабощелочной среде; он имеет высокий оптимум рН и подвержен аллостерическому подавлению валином.
Как видно из этого примера, взаимовлияние двух путей обмена может исключаться в результате образования изоферментов (изоэнзимов), активность одного из которых обычно строго регулируется, тогда как другой не подвергается регуляции того же типа.
вторая - наличие в молекуле фермента пространственно обособленных, но взаимодействующих центров связывания каждого из эффекторов, в результате чего последние не оказывают порознь существенного влияния на активность фермента, а при совместном присутствии подавляют эту активность (согласованное, или мультивалентное ингибирование). Например,активность аспартаткиназы Е. coli подавляется лизином только в сочетании с метионином, лейцином или изолейцином.
В разветвленных биосинтетических путях существует несколько типоврегуляции для ферментов, функционирующих на расходящихся или параллельных путях метаболизма.
Например, имеется какая-то гипотетическая последовательность реакций, в которой А превращается в Е, G и Н, то первый этап, А à В, будет подавляться и в случае накопления лишь одного конечного продукта (например Н).
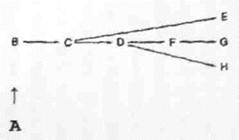
Однако это вызывает также снижение синтеза двух других продуктов - G и Е. Подобные проблемы, возникающиепри регуляции разветвленных путей биосинтеза, разные организмы, разрешили по-разному.
1. Первый этап катализируется несколькими изоэнзимами, каждый из которых регулируется особым конечным продуктом.
2. Первый этап катализируется одним ферментом, при этом возможны разные варианты:
а) для ингибирования общего первого этапа все конечные продукты должны присутствовать в избытке;
б) каждый из конечных продуктов действует независимо от остальных (кумулятивное ингибированиё), причем общее торможение может превышать сумму отдельных эффектов (кооперативное ингибирование).
Регуляция синтеза запасных жиров. Запасные вещества накапливаются, как правило, в тех случаях, когда источники углерода и энергий имеются в избытке, но рост клеток невозможен из-за недостатка соединений азота или серы. Сигнал к образованию жиров (жирных кислот) и полисахаридов исходит главным образом от промежуточных продуктов. У дрожжей реакцией, лимитирующей скорость синтеза жирных кислот, является карбоксилирование ацетил-СоА при участии ацетил-СоА-карбоксилазы. Этот фермент занимает первое место на пути биосинтеза жирных кислот с длинной цепью. Ацетил-СоА-карбоксилаза активируется цитратом. Повышение содержания цитрата, способствуя образованию малонил-СоА, тем самым стимулирует синтез жирных кислот с длинной цепью и нейтральных жиров (триглицеридов). Роль отрицательных эффекторов играют при этом СоА-производные пальмитиновой и других жирных кислот. При накоплении СоА-производных происходит ингибирование конечным продуктом.

Регуляция синтеза запасных полисахаридов. Исходным соединением для синтеза запасных полисахаридов (гликогена и крахмала) служит глюкозо-1-фосфат. Он активируется нуклеозидтрифосфатом (NuTP), после чего глюкозильная группа переносится на полиглюкозную цепь. Регуляция у бактерий осуществляется через пирофосфорилазу. У Escherichia coli, Arthrobacter и Rhodospirillum rubrum, AМФ и AДФ действуют как ингибиторы, а предшественники (глюкозо-1-фосфат) - как стимуляторы.
 |
Регуляция центральных метаболических путей промежуточного обмена. Основное назначение катаболических и центральных метаболических путей - обеспечить клетку энергией и исходным материалом для биосинтеза молекул. Следовательно, вполне закономерно, что для регуляции метаболизма используются конечные продукты энергетического обмена и соединения, играющие роль предшественников в различных процессах биосинтеза. В таблице перечислены некоторые аллостерические ферменты, катализирующие реакции центральных метаболических путей в Е. coli, а также их ингибиторы и активаторы.
Данная регуляция осуществляется по аллостерическому механизму с использованием конечных продуктов энергетического обмена и соединений - предшественников в различных процессах биосинтеза.
Так, увеличение концентрации НАДН2 в клетке сигнализирует о насыщении дыхательной цепи НАДН2 и необходимости уменьшения скорости реакций цикла трикарбоновых кислот (ингибируются цитрат-синтаза, малатдегидрогеназа и пируватдегидрогеназный комплекс). Цитрат-синтаза ингибируется a-оксоглутаратом, а пируват-дегидрогеназный комплекс - ацетил-СоА. Ферменты, которые ингибируются НАДН2, встречаются в основном у грамотрицательных бактерий. В клетках грамположительных бактерий цитрат-синтаза (как и в клетках эукариот) ингибируется АТФ.
Фосфоенолпируват-карбоксилаза ингибируется аспартатом и малатом. Высокое содержание этих соединений служит сигналом, что нет необходимости в синтезе С4-дикарбоновых кислот. С другой стороны, повышение концентрации ацетил-СоА указывает на недостаток С4-дикарбоновых кислот. Таким образом, ацетил-СоА служит активатором фосфоеноллируват-карбоксилазы. Многие микроорганизмы в качестве анаплеротического фермента вместо фосфоенолпируват-карбоксилазы содержат пируваткарбоксилазу. В большинстве случаев пируваткарбоксилаза также активируется ацетил-СоА.
Фруктозо-1,6-бисфосфат - стратегически важный промежуточный продукт, на уровне которого пересекаются пути гликолиза и образования гликогена. При повышении содержания АМФ происходит ингибирование АДФ глюкозо-пирофосфорилазы и фруктозо-бисфосфатазы - двух ферментов, участвующих в синтезе гликогена. Повышение концентрации фруктозо-1,6-бисфосфата положительно сказывается на протекании гликолиза, поскольку и пируваткиназа, и фосфоенолпируват-карбоксилаза активируются фруктозо-1,6-бисфосфатом. Если нет необходимости в дальнейшем увеличении гликолитической активности клетки, фосфоенолпируват ингибирует фосфофруктокиназу, что способствует образованию гликогена.
Таким образом, в бактериальных клетках ферменты-мишени, контролирующие определенные последовательности реакций, обычно катализируют реакции, необратимые при физиологических условиях. Эти ферменты (фосфофруктокиназа, пируваткиназа и т.д.) определяют скорость всей цепи реакций; поэтому регуляция их активности оказывается очень эффективной.
Антагонистические ферменты, например фосфофруктокиназа и фруктозо-1,6-бисфосфатаэа, функционируют в клетке одновременно. Эти ферменты особенно должны находиться под строгим контролем, иначе будут происходить так называемые пустые циклы (бесполезные циклические превращения), сопровождающиеся гидролизом АТФ. Например, фруктозе-6-фосфат будет фосфорилироваться фосфофруктокиназой, а образующийся фруктозобисфосфат снова гидролизоваться фосфатазой.
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 664; Нарушение авторских прав?; Мы поможем в написании вашей работы!