
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Рисунк 31. Взаимодействие белков, вовлеченных в развитие анемии Фанкони
|
|
|
|
Ранее было описано 8 групп комплементации FA, но как и при АТ их число изменилось. Описанная ранее как редкая группа комплементации FAD1 оказалась результатом гомозиготной мутации гена BRCA2, приводящей к синтезу этого белка без крайнего участка С-конца. Эта группа больных характеризуется не только симптомами FA, но и высоким риском возникновения рака молочной железы, что отличает ее от типичных случаев. Другие гены (A, C, D2, Е, F, G,) тоже клонированы. Все они вместе способны образовывать единый ядерный комплекс и связываться с белком BRCA1, с которым обнаруживаются колокализованными в ядре. Вероятно, они участвуют в одном и том же сигнальном пути, активирующемся в ответ на образование поперечных ДНК-сшивок и остановку репликации. Существуют данные еще о двух группах комплементации – связанной с Х-хромосомой FAB и еще одном вероятном участнике того же самого общего ядерного комплекса FAL (именно этот белок представляется необходимым для убиквитинирования FAD2). Схематически все эти взаимодействия белков FA между собой представлены на рис. 31.
Димер FANCD2 напрямую фосфорелируется белком АТМ, и это необходимая составляющая чек-пойнта S-фазы в клеточном ответе на ионизирующее облучение. Нормальное функционирование белков FA необходимо для сохранения хромосомной стабильности в течение S– и G2-фаз клеточного цикла. Для осуществления этой функции, необходимо моноубиквитинирование белка FAD2 по лизину-561, которое осуществляется комплексом белков BRCA1/BARD1 прит обязательном участии общего ядерного комплекса всех остальных FA-белков. Схема процесса показана на рис. 32.
На рис. 32 показано, что шаги a-е важны для обнаружения ДНК-повреждений и активации чекпойнт-ответа. Репарация повреждений, останавливающих репликацию (о которой мы будем подрорбнее говорить позже) может осуществляться с помощью рекомбинации без ошибок (ж) или с помощью синтеза на поврежденной матрице, который может сопровождаться мутациями (з). Вероятно, фосфорелирование или убиквитинирование белка FAD2 может быть важным для выбора между этими путями репарации.
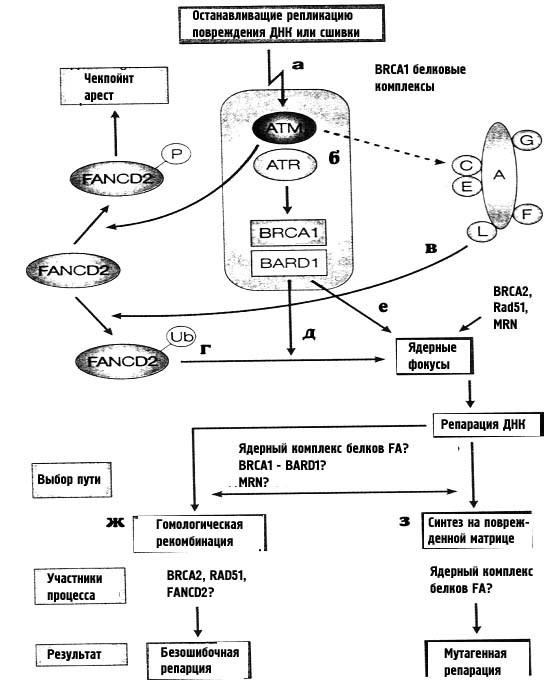
Рисунок 32. Роль белков анемии Фанкони в сохранении клеткой хромосомной стабильности
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 438; Нарушение авторских прав?; Мы поможем в написании вашей работы!