
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Бинарные соединения, их номенклатура
|
|
|
|
КЛАССИФИКАЦИЯ СЛОЖНЫХ ВЕЩЕСТВ
СТЕПЕНЬ ОКИСЛЕНИЯ И ВАЛЕНТНОСТЬ АТОМОВ
ПРОСТЫЕ И СЛОЖНЫЕ ВЕЩЕСТВА
И НОМЕНКЛАТУРА НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
Все вещества можно разделить на простые и сложные.
Простыми называются такиевещества, молекулы которых состоят из атомов одного и того же элемента. Молекулы простых веществ могут состоять из одного (например, Не, Мg, Кr), двух (например, Cl2, Н2, N2) и большего числа атомов (например, О3, S8) одного элемента. Простые вещества подразделяются на металлы и неметаллы. К последним обычно относят H, B, C, N, O, F, Si, P, S, Cl, As, Se, Br, Te, I, At, He, Ne, Ar, Kr, Xe, Rn. Остальные элементы условно считаются металлами.
Сложными веществами или химическими соединениями называются такие вещества, молекулы которых состоят из атомов двух и более элементов. Например NO2, AgCL, NaOH.
Степень окисления (С.О.) – это условный заряд атома в соединении, вычисленный исходя из предложения о чисто ионном характере химической связи. Степень окисления может иметь отрицательное, положительное и нулевое значение, которое обозначают арабскими цифрами со знаком ''+'' или ''-'' и ставят над символом элемента, например:
Cl20, K+2O-2, H+N+5O-2
Нулевую степень окисления имеют нейтральные атомы (например, Mg, H2, O2).
Для ряда элементов степень окисления атомов в соединениях постоянна (см. таблицу 1).
Таблица 1
| Элемент | С. О. |
| Li, Na, K, Rb, Cs, Fr (IА группа), H (кроме гидридов) | +1 |
| Be, Mg, Ca, Sr, Ba (IIА группа) | +2 |
| Al, Sc | +3 |
| Галогены в галлидах (МеГх-1); водород в гидридах (МеНх); кислород в пероксидах (Н2О2) | -1 |
| О (кроме пероксидов) | -2 |
Пользуясь этими сведениями, можно вычислять С.О. других атомов в соединениях, учитывая, что АЛГЕБРАИЧЕСКАЯ СУММА СТЕПЕНЕЙ ОКИСЛЕНИЯ ВСЕХ АТОМОВ В СОЕДИНЕНИИ ВСЕГДА РАВНА НУЛЮ, А В СЛОЖНОМ ИОНЕ – ЗАРЯДУ ИОНА.
Например, в соединениях FeO, NaFeO2, K2FeO4 степень окисления атома железа будет соответственно +2, +3, +6, т.к. С.О. атома кислорода равна -2, натрия и калия - +1, а алгебраическая сумма С.О. всех атомов равна нулю:
Fe+2O-2 Na+Fe+3O2-2 K2+Fe+6O4-2
+2 +(-2)=0 +1+3+2(-2)=0 +1·2+6+4(-2)=0.
Валентность определяется как число химических связей, образуемых данным атомом в соединении.
В простейших случаях валентность атома элемента определяется числом неспаренных электронов в нем, идущих на образование общих электронных пар. Например, в соединениях НС1, СН4, Н2S валентность: С1 - I, C - IV, S - II, т.к. связь в молекулах осуществляется за счет одной, четырёх и двух электронных пар у соответствующего атома (пара электронов при графическом изображении обозначается черточкой).
H―Cl, H―S―H, Н
│
H―C―H
│
H
Сложные вещества по своему составу подразделяются на бинарные соединения (соединения из атомов только двух элементов) и соединения, в составе которых содержатся атомы более двух элементов. Например, из ряда соединений, состав которых выражается формулами NaI, KNO2, AlN, CaH2, Na2SO3, к бинарным относятся: CaH2, NaI, AlN.
По своему составу и свойствам неорганические вещества классифицируют на оксиды, основания, кислоты и соли.
Оксиды – сложные вещества, молекулы которых состоят из атомов кислорода и атомов какого – либо элемента (металла или неметалла).
Примеры оксидов: SO3, CuO, H2O, Fe2O3, CO2.
Основания – сложные вещества, молекулы которых состоят из атомов металла и одной или нескольких гидроксильных групп (-ОН).
Примеры оснований: КОН, Ca(OH)2, Al(OH)3, Fe(OH)2
Кислоты – сложные вещества, молекулы которых содержат атомы водорода, способные замещаться атомами металла с образованием соли. Молекулы всех кислот построены однотипно: они состоят из атомов водорода и кислотных остатков. Кислотные остатки – это атомы или группы атомов, которые остаются после полного или частичного замещения водорода в молекуле кислоты. Например,
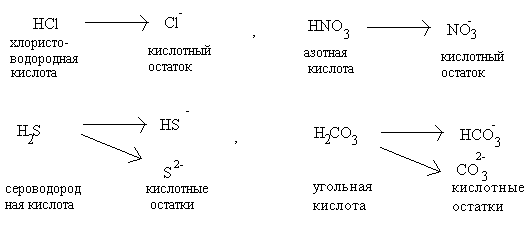 |
Соли – сложные вещества, молекулы которых всегда содержат атомы металла и атомы кислотного остатка. Соли можно рассматривать как продукт полного или частичного замещения атомов водорода в молекулах кислот атомами металлов, или гидроксильных групп в молекулах оснований на кислотные остатки.
Примеры солей: Ca(HCO3)2, Mg3(PO4)2, FeCl2, K2CO3, CuOHCl.
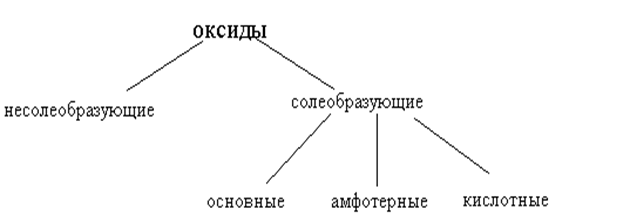
ОКСИДЫ (КЛАССИФИКАЦИЯ)
Состав бинарного соединения можно выразить общей формулой Э'mЭ''n, где атом элемента (Э'') имеет отрицательную степень окисления. Названия бинарных соединений составляются из корня латинского названия электроотрицательного элемента (Э'') с окончанием ''ид'' и русского названия элемента Э' (Э' – элемент с положительной степенью окисления).
Если элемент (Э'), имеющий положительную степень окисления, может находиться в различных степенях окисления, то в скобках римскими цифрами указывается окислительное число (количественное выражение степени окисления).
Примеры бинарных соединений и их названия:
NaH – гидрид натрия, СаН2 – гидрид кальция;
CaF2 –фторид кальция, NaI – иодид натрия;
CrCl3 – хлорид хрома (III), Ca3N2 - нитрид кальция, СаС2 – карбид кальция; Al4C3 – карбид алюминия,
 |
SiC – карбид кремния (IV), BN – нитрид бора;
К бинарным соединениям относятся оксиды, в составе которых атомы кислорода имеют С.О., равную (-2): Al2+3O3-2, Cr+6O3-2, C+4O2-2.
Названия оксидов составляют аналогично другим бинарным соединениям, например, СаО – оксид кальция, Al2O3 – оксид алюминия,
СО2 – оксид углерода (IV), CrO3 – оксид хрома (VI).
При названии оксидов можно указывать греческими числительными (моно, ди, три, тетра) число атомов кислорода, приходящееся на один атом элемента в соединении, например, MnO – монооксид марганца, СО2 – диоксид углерода, СrО3 – триоксид хрома.
По химическим свойствам оксиды делятся на следующие типы:
Основные оксиды – соединения металлов (в низших степенях окисления) с кислородом. Им соответствуют гидроксиды, являющиеся основаниями. Оксиды щелочных и щелочноземельных металлов взаимодействуют (растворяются) с водой с образованием оснований (растворимых в воде – щелочей). Например:Na2O + H2O = 2NaOH; CaO + H2O = Ca(OH)2.
Основные оксиды остальных металлов не растворяются в воде и соответствующие им гидроксиды (основания) получают из солей реакцией обмена со щёлочью. Названия основных гидроксидов определяется названием образующих их металлов.
Таблица 2
| Оксид | Соответствующий ему гидроксид | Название |
| K2O | KOH | Гидроксид калия |
| ВаО | Ва(ОН)2 | Гидроксид бария |
| Al2O3 | Al(OH)3 | Гидроксид алюминия |
Кислотные оксиды (или ангидриды кислот)- это такие оксиды, которым соответствуют гидроксиды – кислоты. К ним относятся оксиды неметаллов (например, СО2, SO3, P2O2) и оксиды некоторых металлов в их высших степенях окисления (например, CrO3, V2O5, Mn2O7).
Кислотные оксиды можно рассматривать как продукты дегидратации кислот (ангидриды). Например:
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 4419; Нарушение авторских прав?; Мы поможем в написании вашей работы!