
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Состав и свойства природного газа
|
|
|
|
Природный газ представляет собой смесь предельных углеводородов состава СпН2п+2, в которой содержится метан, этан, пропан, бутан и иногда пары более тяжелых углеводородов. Часто в состав природных газов входят азот N2 (до 40 % по объему), углекислота СО2, сероводород H2S и редкие газы.
В газе газовых и газоконденсатных месторождений обычно преобладает метан; его доля достигает 98,8 %; в нефтяном (попутном) газе доля метана намного меньше, однако увеличивается доля более тяжелых углеводородов — этана, пропана и бутана [5, 7, 13, 41].
Состав газовых смесей выражается в виде массовой, объемной или молярной доли компонентов в процентах. Массовая доля в процентах какого-либо компонента газовой смеси представляет собой отношение массы этого компонента к массе всей смеси:

где Мi — масса i -го компонента; Mсм — масса смеси.
Объемная доля (%) какого-либо компонента в смеси газов равна отношению объема компонента к объему всей смеси:
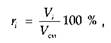
где Vi — объем /-го компонента в смеси; Vсм — объем всей смеси.
Молярная доля компонента определяется аналогично и может быть представлена в виде

где N i — число молей г-го компонента в смеси; Ncm — суммарное число молей газа в смеси.
Физические свойства природного газа зависят от его состава, но в целом близки к свойствам метана как основного компонента смеси.
Плотность природного газа можно определить взвешиванием или вычислить, зная молекулярную массу смеси М:

где Vm — объем моля газа при стандартных условиях, м3.
Обычно рг находится в пределах 0,73— 1,0 кг/м3. В расчетах часто используют более удобную величину — относительную плотность Δ так как значение ее практически не зависит от давления и температуры. За величину сравнения принимают плотность воздуха

где МГ — масса газа; Мв — масса воздуха.
Относительная плотность газа изменяется от 0,50 до 1,0. Плотность индивидуальных компонентов углеводородных газов (и сероводорода), за исключением метана, больше единицы. При всех расчетах, связанных с движением газа, используется вязкость. Аналитические зависимости вязкости смеси от вязкости входящих в смесь компонентов сложны и имеют недостаточную точность. В связи с этим на практике вязкость определяют по экспериментальным графикам, один из которых приведен на рис. 1.2.

|
| Рис. 1.2. Зависимость вязкости природного газа μ (при Δ = 0,6) от температуры |
Вязкость природных газов зависит от их состава, температуры и давления. При высоком давлении вязкость растет с увеличением плотности газа, при низком — уменьшается. С повышением давления вязкость увеличивается. Температура влияет на вязкость по-разному: при низких давлениях с повышением температуры она увеличивается, а при высоких (5—10 МПа) — снижается. Такие свойства объясняются степенью близости газа к жидкому состоянию. Вязкость природных газов обычно составляет (1,1 — 1,6)-10~5 Пас.
Состояние газа характеризуется давлением р, температурой Т и объемом V. Соотношение между этими параметрами определяется законами идеальных газов (Бойля — Мариотта, Гей-Люссака и др.), которые имеют чрезвычайно большое
|
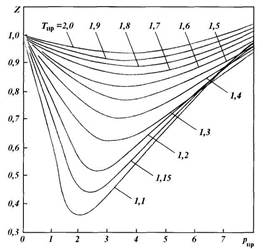
| Рис. 1.3. Зависимость коэффициента сжимаемости природного газа от приведенного давления при различных температурах |
значение в технологии добычи и транспортирования нефти и газа. Однако состояния реальных и идеальных газов в определенных условиях существенно отличаются. Поэтому для расчета состояния реальных газов обычно пользуются обобщенным газовым законом в виде уравнения Клапейрона, в которое вводится поправка (коэффициент сжимаемости Z), учитывающая отклонение реальных газов от законов сжатия и расширения идеальных газов:
pV = ZMRT,
где Z — коэффициент сжимаемости; М — масса газа; р — давление; V — объем газа; R — газовая постоянная; Т — абсолютная температура.
Для нефтяных газов значение коэффициента сжимаемости Z можно найти приближенно
|
| Относительная плотность газа |
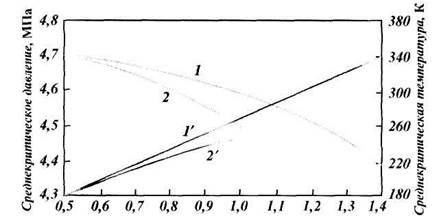
| Рис. 1.4. Зависимость среднекритического давления (1, 2) и температуры (1 ' 2') природного газа от относительной плотности: |
| 1, 1' — газовое месторождение; 2, 2' — газоконденсатное месторождение |
по графикам Брауна, представленным на рис. 1.3. Коэффициенты сжимаемости Z на этом графике зависят от приведенных давления рпр и температуры Тпр, значения которых можно определить по формулам
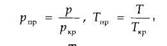
где р и Т — соответственно давление и температура газа; ркр и Ткр - критические давления и температура.
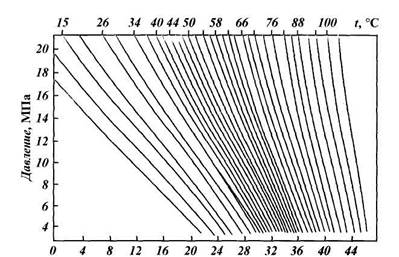
|
| Энтальпия, кДж/кг |
| Рис. 1.5. Энтальпия природного газа в зависимости от давления и температуры (при относительной плотности газа Δ = 0,6) |
Для смесей газов критические температуру и давление определяют по формулам или приближенно по графикам рис. 1.4 как функцию относительной плотности смеси. При добыче природного газа часто приходится иметь дело с процессами дросселирования, т. е. с изменением давления без совершения внешней работы. Температура идеального газа при этом остается постоянной. Температура реального газа изменяется, что очень важно учитывать, так как это явление связано с выпадением из него влаги и углеводородного конденсата. Снижение давления в области относительно низких давлений (до 40 МПа) приводит к охлаждению газа, в области высоких — к нагреванию. Изменение температуры газа при его дросселировании носит название эффекта Джоуля-Томсона. Различают дифференциальный и интегральный эффекты. Большое практическое значение имеет интегральный эффект Джоуля — Томсона, т. е. понижение температуры
газа на конечном участке изменения его давления. Эту величину обычно находят по кривым теплосодержания (рис. 1.5). Зная давление газа и его температуру при одном состоянии, по этим кривым можно найти температуру газа после дросселирования. Для этого от первоначальной точки по линии равного теплосодержания следует переместиться в точку нового значения давления. Температура, соответствующая этой точке, явится искомой величиной. Изменение температуры газа при снижении давления на 0,1 МПа называется коэффициентом Джоуля — Томсона. Эта величина составляет 0,25 — 0,35 °С на 0,1 МПа (1 атм).
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 1626; Нарушение авторских прав?; Мы поможем в написании вашей работы!