
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая природа гормонов 2 страница
|
|
|
|
Инкреция кортикостероидов корковым слоем надпочечников возникает в эмбриогенезе сравнительно рано — на 7-8 неделе внутриутробного развития. Общий уровень выработке кортикостероидов нарастает сначала медленно, а затем быстро, достигая максимума в 20 лет, а затем падает к старости. При этом быстрее всего к старости уменьшается выработка минералокортикоидов, несколько медленнее — андростероидов и еще медленнее — глюкокортикоидов.
Адреналин и норадреналин появляются в мозговом веществе надпочечников очень рано. Уже при рождении уровень инкреции адреналина в надпочечниках сопоставим с уровнем взрослого человека. (Выделение катехоламинов в моче у молодых, зрелых и пожилых людей почти не изменяется с возрастом).
В корковом слое вырабатываются несколько гормонов — кортикостероидов, оказывающих влияние на солевой и углеводный обмены, способствующих отложению гликогена в клетках печени и поддерживающих постоянную концентрацию глюкозы в крови. При недостаточной функции коркового слоя развивается Аддисонова болезнь, сопровождающаяся мышечной слабостью, одышкой, потерей аппетита, уменьшением концентрации в крови сахара, понижением температуры тела. Кожа при этом приобретает бронзовый оттенок — характерный признак данного заболевания. В мозговом слое надпочечников вырабатывается гормон адреналин. Его действие многообразно: он увеличивает частоту и силу сердечных сокращений, повышает кровяное давление (при этом просвет многих мелких артерий сужается, а артерии головного мозга, сердца и почечных клубочков расширяются), усиливает обмен веществ, особенно углеводов, ускоряет превращение гликогена (печени и работающих мышц) в глюкозу, в результате чего работоспособность мышц восстанавливается.
Поджелудочная железа (рис. 379) располагается позади желудка, обычно на уровне первого и второго поясничных позвонков, и занимает пространство от двенадцатиперстной кишки до ворот селезенки.
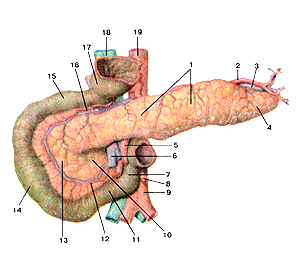
Рисунок 379. Поджелудочная железа (pancreas). Панкреатические островки. 1 - тело поджелудочной железы; 2 - селезеночная артерия; 3 - селезеночная вена; 4 - хвост поджелу-дочной железы; 5 - верхняя брыжеечная артерия; 6 - верхняя брыжеечная вена; 7 - восходящая часть двенадцатиперстной кишки; 8 - нижняя брыжеечная артерия; 9 - аорта; 10 - крючко-видный отросток поджелудочной железы; 11 - нижняя (горизонтальная) часть двенадцати-перстной кишки; 12 - нижняя поджелудочно-двенадцатиперстная артерия; 13 - головка поджелудочной железы; 14 - нисходящая часть двенадцатиперстной кишки; 15 - верхняя (горизонтальная) часть двенадцатиперстной кишки; 16 - верхняя поджелудочно-двенадцати-перстная артерия; 17 - пилорический отдел желудка (отрезан); 18 - нижняя полая вена; 19 -аорта.
Длина ее — 10-23 см, ширина — 3-9 см, толщина — 2-3 см, масса — 70-100 г. В поджелудочной железе различают три отдела: головку, тело и хвост. Она функционирует как смешанная железа, гормон которой — инсулин — вырабатывается клетками островков Лангерганса. Эндокринную функцию поджелудочной железы осуществляют клетки, расположенные в виде островков (рис. 380) (островки Лангерганса). Эти клетки вырабатывают гормон —  инсулин. Инсулин действует главным образом на углеводный обмен, оказывая действие, противоположное адреналину. Основная функция инсулина — сохранение углеводов в организме и пополнение запасов глюкагона. При снижении выработки инсулина большая часть глюкозы выводится из организма с мочой (диабет). Гормоны вырабатываются в поджелудочной железе клетками островков Лангерганса. Альфа-клетки вырабатывают гормон глюкагон, который способствует превращению гликогена печени в глюкозу крови, в результа- Рисунок 380. те чего увеличивается количество сахара в крови. Второй гормон — инсу-лин — вырабатывается бета-клетками островков поджелудочной железы. Он способствует отложению гликогена в печени и уменьшению количества сахара в крови. При недостаточной функции поджелудочной железы, появляющейся в результате ее заболевания или частичного удаления, развивается тяжелое заболевание — сахарный диабет.
инсулин. Инсулин действует главным образом на углеводный обмен, оказывая действие, противоположное адреналину. Основная функция инсулина — сохранение углеводов в организме и пополнение запасов глюкагона. При снижении выработки инсулина большая часть глюкозы выводится из организма с мочой (диабет). Гормоны вырабатываются в поджелудочной железе клетками островков Лангерганса. Альфа-клетки вырабатывают гормон глюкагон, который способствует превращению гликогена печени в глюкозу крови, в результа- Рисунок 380. те чего увеличивается количество сахара в крови. Второй гормон — инсу-лин — вырабатывается бета-клетками островков поджелудочной железы. Он способствует отложению гликогена в печени и уменьшению количества сахара в крови. При недостаточной функции поджелудочной железы, появляющейся в результате ее заболевания или частичного удаления, развивается тяжелое заболевание — сахарный диабет.
Инсулиновый аппарат поджелудочной железы развивается очень рано. С возрастом увеличивается общее количество островков Лангерганса, но при пересчете на единицу массы их количество, наоборот, значительно снижается по мере старения. Было также отмечено и возрастное уменьшение гормона в эндокринной железе.
На рис.381 показан средний уровень содержания в крови инсулина и глюкозы. Как видно из таблиц, содержание инсулина с возрастом несколько повышается, но недостаточно для снижения уровня сахара в крови, что говорит о подавлении инсулиновой функции в позднем онтогенезе. Это подтверждается и в опытах на животных.
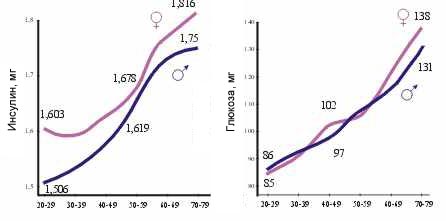
Рисунок 381. Средний уровень содержания в крови инсулина и глюкозы у человека.
В пользу некоторой инсулиновой недостаточности в старости свидетельствуют и данные исследований при одинарной и двойной сахарной нагрузке и установивших высокую толерантность молодых и зрелых индивидуумов (в пределах от 5 до 50-летнего возраста).
Так, на рис. 382 показана выраженность гипергликемии и скорость ее устранения при двойной глюкозной нагрузке у людей разного возраста.

Рисунок 382. Выраженность гипергликемии и скорость ее устранения при двойной глюкозной нагрузке у людей разного возраста.
Особенно ярко заметна удивительная высокая толерантность к сахарным нагрузкам детей и юношей, которая несколько снижается в зрелом возрасте и очень существенно снижена в старости. Поэтому является обоснованным считать употребление больших количеств сахара в молодости и необходимо ограничение его потребления в старости, так как нарастает угроза возникновения диабета.
Инсулин регулирует углеводный обмен, т.е. способствует усвоению клетками глюкозы, поддерживает ее постоянство в крови, переводя глюкозу в гликоген, который откладывается в печени и мышцах. Второй гормон этой железы — глюкагон. Его действие противоположно инсулину: при недостатке глюкозы в крови глюкагон способствует превращению гликогена в глюкозу. При пониженной функции островков Лангерганса нарушается обмен углеводов, а затем белков и жиров. Содержание глюкозы в крови возрастает с 0,1 до 0,4%, она появляется в моче, а количество мочи увеличивается до 8-10 л. Это заболевание называется сахарным диабетом. Его лечат путем введения человеку инсулина, извлеченного из органов животных.
Деятельность всех желез внутренней секреции взаимосвязана: гормоны передней доли гипофиза способствуют развитию коркового вещества надпочечников, усиливают секрецию инсулина, влияют на поступление в кровь тироксина и на функцию половых желез. Работу всех желез внутренней секреции регулирует центральная нервная система, в которой находится ряд центров, связанных с функцией желез. В свою очередь гормоны влияют на деятельность нервной системы. Нарушение взаимодействия этих двух систем сопровождается серьезными расстройствами функций органов и организма в целом.
Эпифиз, или шишковидное тело (рис. 383) — овальное железистое образование, относящееся к промежуточному мозгу.

Рисунок 383. Эпифиз (epiphysis). Вид сверху. 1 - внутренние мозговые вены; 2 - третий желудочек; 3 - эпифиз; 4 - большая вена мозга; 5 - сосудистое сплетение бокового желудочка; 6 - таламус; 7 - столбы свода мозга.
Эпифиз расположен между зрительными буграми и четверохолмием. Длина его — 8 мм, вес, в среднем, — 0,118 г, ширина — 4-6 мм. Паренхиму эпифиза составляют крупные светлые клетки, состоящие из цитоплазмы и ядер с базофильной зернистостью и содержащие нуклеиновые кислоты РНК и ДНК. Инволюция эпифиза начинается с 4-5-летнего возраста. После 8 лет в эпифизе происходит обызвествление, состоящего из органической основы, карбоната и фосфата кальция и магния. Эпифиз считают железой внутренней секреции, однако роль его в организме еще полностью не изучена. Он участвует в регуляции обмена фосфора, калия, кальция и магния, а также водно-солевого обмена. Основным гормоном эпифиза является мелатонин — ингибитор развития и функционирования половых желез. Обнаружено, что поражение эпифиза у детей сопровождается преждевременным половым созреванием, то есть ему принадлежит сдерживающее влияние на развитие половых желез.
Таким образом, эпифиз раннего детства может выполнять свою сдерживающую функцию, продуцируя повышенное количество мелатонина. Максимальная активность в раннем детстве (5-7 лет) и именно к этому периоду относится максимальное сдерживающее влияние. Позднее эпифиз подвергается значительной инволюции, правда весьма неравномерной.
В слизистой оболочке желудка и кишечника (рис. 384) имеются не собственно железы, а разрозненные  клетки эндокринного типа. Выделяемые ими желудочно-кишечные гормоны регулируют пищева-рительные процессы, активизируя выделение различных соков или вызывая угнетающий эффект.
клетки эндокринного типа. Выделяемые ими желудочно-кишечные гормоны регулируют пищева-рительные процессы, активизируя выделение различных соков или вызывая угнетающий эффект.
Гастрин стимулирует слизистую оболочку желудка, когда в нее попадает пищевой комок.
Его антагонист энтерогастрон, вырабатываемый в слизистой оболочке двенадцатиперстной кишки, сокра-щает выделение соков и частоту перистальтических дви-жений.
В двенадцатиперстной кишке вырабатываются панкреозимин и секретин, стимулирующие выделение поджелудочного сока, а также холецистокинин, способст-вующий выбросу желчи при поступлении жирных веществ.
И, наконец, энтерокинин, вырабатываемый в слизис-той оболочке кишечника, стимулирует выделение сока в этом органе.
Рисунок 384.
ГЛАВА 7. ИММУННАЯ СИСТЕМА
Термин «иммунитет» имеет латинский корень, обозначающий освобождение, избавление от чего-либо. Первоначально в биологии под иммунитетом понимали резистентность или невосприимчивость организма к действию микроорганизмов.
Однако со временем это понятие было изменено и сейчас к нему относят реакции организ-ма, направленные на нейтрализацию всего чужеродного, попадающего в его внутреннюю среду.
Помимо защиты от микроорганизмов, иммунная система бдительно отслеживает пути проникновения в организм чужеродного белка с вдыхаемым воздухом, через кожу или стенку кишечника, инъекционным путем и при этом стремится нейтрализовать его действие.
Эта система также отслеживает отклонения в «поведении» собственных клеток организма, оберегая его от размножения тех из них, которые склонны к злокачественному росту.
Несколько условно, но спектр иммунных ответов в отношении чужеродных микробов, виру-сов или токсинов, чужеродных белков, а также поврежденных или измененных клеток можно разделить на 3 типа — это неспецифическая резистентность, врожденный иммунитет и приобретенный иммунитет. И хотя все эти типы иммунного ответа так или иначе связаны между собой, они имеют определенную специфичность.
Неспецифическая резистентность определяется целостностью кожных покровов и слизис-тых, их функциональной активностью, а также состоянием фагоцитов.
Врожденный иммунитет определяется в значительной степени системой комплемента. И, наконец, носителями приобретенного иммунитета являются Т- и В- лимфоциты.
Специфичность и память — это две основных характеристики приобретенного иммунитета. Механизмы, обеспечивающие естественную резистентность (неспецифическую защиту), не зависят от антигенной специфичности чужеродного агента. Они не распознают попадающие в организм вещества и инфекты (инфекционные агенты), как генетически чужеродный материал, но в большинстве случаев действуют не менее эффективно, чем факторы приобретенного им-мунитета, способствуя их элиминации.
Вместе с тем механизмы естественной резистентности и приобретенного иммунитета тесно переплетаются: их взаимодействие осуществляется на всех этапах проникновения, размноже-ния возбудителя в организме и его элиминации. Факторы естественной резистентности первыми «встают» на защиту при действии патогенных (чаще всего инфекционных) агентов.
В системе неспецифической резистентности центральное место занимают две основные клеточные популяции: моноциты-макрофаги и нейтрофилы-макрофаги (нейтрофилы, эозино-филы, базофилы). В определенных случаях они способны переходить из одной формы в другую: из базофилов формируются тучные клетки, моноциты превращаются в макрофаги.
Мононуклеарные моноциты (помимо участия в фагоцитозе) выполняют важную функцию в специфическом иммунитете — являются антигенпрезентирующими клетками, т.е. подготавли-вают антиген для узнавания специализированными лимфоцитами.
Помимо мононуклеарных моноцитов, к клеткам неспецифической резистентности относят и так называемые натуральные или естественные киллеры (НК), берущие свое начало от прелимфоцитов, дифференцировка которых завершается в селезенке.
Ключевое место во врожденном иммунитете занимает система комплемента. Термин «комп-лемент» впервые был применен для описания неких необходимых «дополнительных» субстратов в сыворотке, для лизиса бактерий под действием специфических антител. В настоящее время к системе комплемента относят более 25 белков и их активных фрагментах, из которых девять — комплементные белки (С1-С9), а остальные — факторы комплемента (B, D, P, H и др.).
Главной функцией системы комплемента является отличие «своего» от «чужого», что осуществляется за счет регуляторных молекул находящихся на клетках организма и подавляющих активацию комплемента.
При попадании в кровь и ткани активаторов (грамм-положительные или грамм-отрицатель-ные бактерии, вирусы, другие микроорганизмы, иммунные комплексы) происходит каскадное взаимодействие белков системы комплемента с образованием промежуточных продуктов, повреждающих мембраны клеток-мишеней.
Центральное место в системе комплемента занимает белок С3. В плазме крови постоянно происходит «холостая» активация С3, приводящая к фиксации небольшого числа его молекул на поверхности как «своего», так и «чужого».
На поверхности собственных клеток регуляторные белки вызывают разрушение связавшихся молекул С3 и подавляют дальнейшую активацию комплемента. На чужеродных структурах, лишенных регуляторных белков, напротив, начинается его активация.
Итак, функции системы комплемента — это: лизис клеток; растворение иммунных комплексов; участие в фагоцитозе; воспалительной реакции; образование хемотаксинов; модуляция иммунного ответа; нейтрализация веществ.
Носителями приобретенного иммунитета, являются Т- и В-лимфоциты. В костном мозге образуются полипотентные стволовые клетки, дающие начало всем формам кровяных и лимфоидных клеток. Стволовые клетки, дифференцирующиеся по лимфоидному типу, мигри-руют в тимус или созревают до зрелых форм в костном мозге.
Клетки, созревающие до зрелых форм в тимусе, получили название Т-лимфоцитов. Клетки, созревающие в костном мозге, называются В-лимфоцитами. Клетками, продуцирующими антитела, являются плазмоциты — потомки активированных В-лимфоцитов. До середины 60-х годов казалось, что основные клетки Т- и В-систем осуществляют иммунологические функции автономно. Первые из них предназначены для реализации клеточного типа ответа, вторые — гуморального. В тех случаях, когда организм инфицируется бактериями, основная нагрузка падает на В-систему иммунитета. Конечным результатом работы В-системы является накопле-ние специфических антител, которые нейтрализуют бактерии или их токсины. Если организм столкнулся с вирусной инфекцией, то в работу вступает Т-система иммунитета, составляю-щими элементами которой являются указанные выше субпопуляции Т-лимфоцитов, антиген-распознающие рецепторы, находящиеся на поверхности этих клеток (Т-клеточные рецепторы — ТКР), а также цитокины или группа регуляторных молекул. Одна из клеточных субпопуля-ций этой системы — Т-киллеры (цитотоксические Т-лимфоциты) являются основным компонентом антивирусного иммунитета.
Следующим этапом в понимании иммунной системы стало открытие закономерностей реакции отторжения трансплантата от тканей хозяина. Был открыт комплекс антигенов, локализованных на лимфоцитах и имеющих непосредственное отношение к реакции отторжения трансплантанта — Нuman Leukocyte Antigen (HLA — человеческий антиген лейкоцитов).
До конца 60-х — начала 70-х годов было известно лишь одно свойство этого комплекса — контроль синтеза антигенов, вызывающих иммунную реакцию отторжения пересаженной ткани.
Затем, при изучении генетического контроля силы иммунного ответа и, особенно, анализе механизмов взаимодействия генетически отличающихся клеток был выявлен достаточно широкий спектр биологической активности HLA комплекса. По мере расширения знаний об участии комплекса в формировании иммуннитета, последний получил название главного комплекса гистосовместимости (ГКГ).
Антигены ГКГ представляют собой белковые комплексы, находящиеся на поверхности клеток. Они кодируемые группой тесно сцепленных генов, находящихся на коротком плече 6-й хромосомы. ГКГ занимает 3500 kb (kb — это тысяча пар оснований) и содержит более 220 генов. Выделено 3 класса генов ГКГ. Поэтому и продукты ГКГ принято подразделять на антигены трех классов. При этом многие черты контролируемых ГКГ белков свойственны одному или другому классу, хотя некоторые черты могут быть характерны для двух классов.
Практически на всех ядросодержащих клетках (кроме клеток нейроглии ворсинчатого трофобласта человека) имеются антигены HLA класса I. Они широко представлены на лимфоидных клетках и в меньшей степени — клетках печени, легких, почек. Еще реже они встречаются на клетках мозга и скелетных мышц.
Распределение антигенов HLA класса II более ограничено. Они ассоциированы с B-лимфоцитами, антигенпрезентирующими клетками (клетки Купфера, дендритные клетки, клетки альвеолярного эпителия легких) и макрофагами.
Структура генов ГКГ класса I и класса II исследована достаточно полно: определена аминокислотная последовательность десятков аллельных вариантов этих молекул; выяснена пространственная структура некоторых из них, например, HLA-A2. Оба класса белков HLA антигенов относятся к иммуноглобулиновому суперсемейству.
ГКГ принадлежит центральное место в дифференцировке и окончательном созревании Т-лимфоцитов. Именно в тимусе происходят процессы дифференцировки Т-клеток на субпопуляции (Т-киллеры, Т-хелперы, Т-супрессоры).
Основная причина массовой гибели более 90% поступающих из костного мозга ранних предшественников Т-клеток.связана с жесткостью селекционных процессов — положительным отбором только тех клеток, которые способны реагировать со своими собственными антигенами ГКГ. Все остальные клетки, не прошедшие контроля на специфичность, погибают. Таким образом, в определении судьбы тимоцитов антигены гистосовместимости выступают и как факторы селекции, определяя становление клонов Т-клеток, способных распознавать собственные антигены, и как факторы дифференцировки, от которых зависит формирование функционально самостоятельных субпопуляций. Часть генов ГКГ вовлечена в процессы диф-ференцировки клеток у эмбриона, а возможно, и в плаценте.
Проникшие в организм чужеродные антигены (бактерии, вирусы, трансплантационные антигены, белки и др.) провоцируют образование строго специфических антител и/или форми-руют соответствующий клон лимфоцитов.
Под антигенами подразумеваются химические вещества, свободные, либо входящие в состав клеток, способные индуцировать иммунный ответ, сводящийся к удалению этого агента из организма.
Как правило, полноценный антиген состоит из двух частей: носителя и эпитопа. Носитель или стабилизирующая часть составляет до 97-99% массы молекулы антигена и представляет собой, как правило, инертную часть антиген. Эпитоп или детерминантная часть молекулы антигена (олигосахариды или олигопептиды), располагающиеся на поверхности молекулы (эпи-). Именно детерминантная группа определяет специфичность антигена.
По своей природе все существующие антитела представляют собой иммунноглобулины. Хотя иммуноглобулины и антигенсвязывающие рецепторы имеют между собой определенные различия, разнообразие антигенной специфичности тех и других формируется сходными механизмами. У млекопитающих, включая человека, известны 5 классов иммуноглобулинов: IgM, IgG, IgA, IgD и IgE.
Каждый класс обладает своими структурными и биологическими свойствами, однако все они построены по общему плану.
Иммунная система представляет собой комплекс специализированных лимфоидных органов, а также диссеминированных клеток мезенхимального происхождения, способных выполнять иммунологические функции. Гистологически иммунная система практически соответствует лимфоидной ткани. Важнейшая особенность последней состоит в том, что она распространена по всему организму, исключая немногие органы или отдельные их участки, называемые иммунологически привилегированными. При этом локализация клеток иммунной системы, прежде всего лимфоцитов, отнюдь не ограничивается лимфоидными органами: значительная их часть рециркулирует (т.е. постоянно поступает в кровоток и возвращается обратно) и при этом может мигрировать не только в лимфоидную ткань. Иммунная система обладает собственной системой циркуляции — лимфатическими сосудами[1], которые имеются во всех органах, кроме головного мозга. По лимфатическим сосудам течет бесцветная, густая жидкость (лимфа), содержащая жиры и лейкоциты (лимфоциты). В лимфатических узлах, миндалинах, костном мозге, селезенке, печени, легких и кишечнике — расположены особые зоны, где лимфоциты скапливаются, мобилизуются и откуда они отправляются выполнять свои защитные функции. Сложное строение иммунной системы гарантирует в случае необходимости быстрое развитие иммунного ответа.
В схематизированной форме структура иммунной системы и взаимосвязи составляющих ее органов представлена на рисунках 385 и 386.
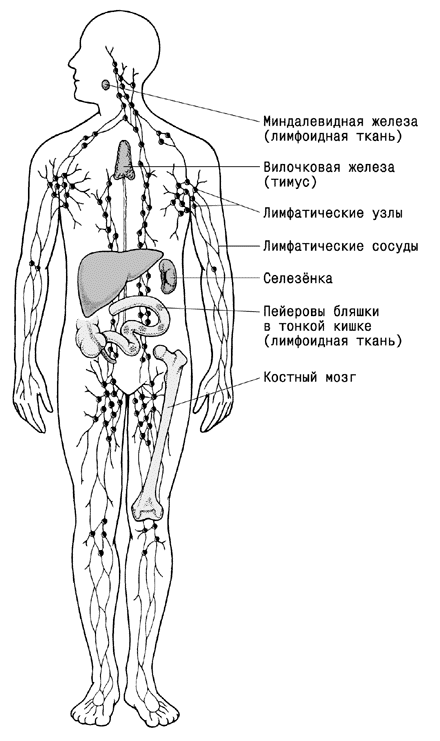
Рисунок 385. Основные органы иммунной системы человека

Рисунок 386. Взаимосвязи органов иммунной системы. Показаны взаимоотношения цент-ральных и периферических органов иммунной системы и направления миграции лимфоцитов в процессе созревания и рециркуляции (указано стрелками). В — В-лимфоциты; М — моноциты; Г — гранулоциты; Т — Т-лимфоциты.
Органы иммунной системы. Хотя клетки, выполняющие иммунологические функции, рассеяны по всему организму, к иммунной системе, строго говоря, относятся лишь лимфоидные органы и лимфоидные скопления, т.е. органы и структурные образования, основу которых составляют лимфоциты. Лимфоидные органы разделяют на центральные (первичные) и периферические (вторичные). Такими органами являются красный костный мозг, тимус, лимфатические узлы, селезенка и кишечные пластинки Пэйе.
Таблица 17. Органы и другие структурные образования иммунной системы
| Группы органов и структур | Органы и структуры |
| Источники клеток-пред-шественников | В эмбриогенезе — желточный мешок, печень; у взрослых — костный мозг (для В1 — сальник) |
| Центральные органы В-лимфопоэза | Плевроперитонеальная полость (?) |
| Центральный орган Т-лимфопоэза | Тимус |
| Периферические лимфоид-ные органы | Лимфатические узлы, селезенка, миндалины, групповые лимфатические фолликулы (пейеровы бляшки), аппендикс |
| Лимфоидные скопления в нелимфоидных органах | Внутриэпителиальные лимфоциты слизистых оболочек и кожи, lamina propria кишечника и матки, солитарные фолликулы слизистых оболочек; молочные пятна сальника |
| Циркуляция | Кровь, лимфа |
Иммунная система не только подвижная, но и непрерывно обновляющаяся. В то же время постоянство ее состава поддерживается достаточно строго. Хотя принципы этого гомеостаза еще недостаточно понятны, очевидно, что регуляция осуществляется на уровне отдельных разделов (компартментов) системы: численность и состав клеток костного мозга, тимуса и периферических лимфоидных органов регулируются самостоятельно и относительно независимо друг от друга, причем периферические лимфоидные органы регулируются как единое целое.
Уникальная особенность лимфоидных клеток состоит в том, что для их терминального созревания во внутренней среде организма в норме отсутствуют необходимые стимулы: для этого требуется поступление извне или образование внутри (вследствие патологического процесса) чужеродной субстанции — антигена. Лишь при появлении последнего во внутренней среде организма лимфоциты превращаются в эффекторные клетки, способные выполнять иммунологические функции, которые и служат конечными стадиями их развития.
Костный мозг. В костном мозгу (рис. 387) образуются все форменные элементы крови, включая  лейкоциты — клетки, непосредственно связанные с иммунной системой. Часть клеток, развивающихся из костномозговых предшественников и относящихся к иммунной системе, практически не определяется в крови, таковы дендритные и тучные клетки. Кроветворная ткань представлена в костном мозгу цилиндрическими скоплениями вокруг артериол, образующими шнуры, отделенные друг от друга венозными синусоидами. Они расположены радиально и впадают в центральный синусоид. Клетки различных типов располагаются в кроветворной ткани островками. Наибольшее число стволовых элементов сосредоточено в периферической части просвета костномозгового канала. Рядом с ними вокруг разветвлений артериол располагаются лимфоидные и моноцитарные Рисунок элементы, тогда как предшественники нейтрофильных гранулоцитов сосредото-
лейкоциты — клетки, непосредственно связанные с иммунной системой. Часть клеток, развивающихся из костномозговых предшественников и относящихся к иммунной системе, практически не определяется в крови, таковы дендритные и тучные клетки. Кроветворная ткань представлена в костном мозгу цилиндрическими скоплениями вокруг артериол, образующими шнуры, отделенные друг от друга венозными синусоидами. Они расположены радиально и впадают в центральный синусоид. Клетки различных типов располагаются в кроветворной ткани островками. Наибольшее число стволовых элементов сосредоточено в периферической части просвета костномозгового канала. Рядом с ними вокруг разветвлений артериол располагаются лимфоидные и моноцитарные Рисунок элементы, тогда как предшественники нейтрофильных гранулоцитов сосредото-
387. чены в центре гемопоэтических долек. Размножающиеся и созревающие кроветворные клетки располагаются в петлях, которые образуют ретикулярные клетки. По мере созревания клетки (в частности, лимфоидные) перемещаются из периферической части просвета к центру, где они проникают в синусоиды и поступают в кровоток.
На долю миелоидных элементов в костном мозгу человека приходится 60—65 % клеток, на долю лимфоидных — около 10-15 % кариоцитов. Примерно 60 % лимфоидных клеток нахо-дится в процессе созревания, остальные — зрелые клетки, готовые к эмиграции из костного мозга или, наоборот, мигрировавшие в костный мозг из крови. Доля ежедневно эмигрирующих лимфоцитов составляет у мышей около 50 % от общего числа лимфоидных элементов в костном мозгу (180 из 230-320 млн клеток). Обратный приток лимфоцитов из крови в костный мозг в 10 раз меньше (20 млн клеток в день). Содержание в костном мозгу лимфоцитов В-ряда выше, чем Т-клеток и их предшественников. В костном мозгу содержится 1-2 % плазматических клеток, что можно рассматривать как отражение иммунных реакций, реализуемых в костном мозгу.
В-росток лимфопоэза отличается большой интенсивностью функционирования. За сутки у мыши образуется 20-50 млн В-клеток, что значительно превосходит число клеток, требующихся для обновления популяции В-лимфоцитов. Полагают, что значительная часть образующихся клеток гибнет на стадии преВ-лимфоцитов. В настоящее время признано, что костный мозг служит основным местом дифференцировки В-лимфоцитов у млекопитающих (хотя признается роль в В-лимфопоэзе групповых лимфатических фолликулов толстой кишки у овец и некоторые другие особые случаи экстрамедуллярной дифференцировки В-клеток).
Небольшое количество (7-8%) кариоцитов костного мозга приобретает маркеры Т-клеток под влиянием дифференцировочных факторов, т.е. представляют собой предшественники Т-лимфоцитов. Часть из них экспрессирует маркеры Т-лимфоцитов — CD7, 2 и 5.
Формирование этих маркеров зависит от гормонов тимуса, приносимых в костный мозг с кровью. У клеток-предшественников, испытавших воздействие этих гормонов, повышается способность к миграции в тимус, в котором они продолжают свое развитие. На костномозговой стадии развития предшественники Т-лимфоцитов стимулируют (при участии выделяемого ими гуморального фактора) пролиферацию стволовых клеток.
До 4% клеток костного мозга (20-30% от общего числа его лимфоидных клеток) несут маркеры зрелых Т-лимфоцитов, в частности CD3. Часть из них — Т-клетки, мигрировавшие из крови, — является представителями рециркулирующего пула лимфоцитов. Для этих клеток характерно преобладание СD8+-лимфоцитов над СD4+-лимфоцитами: соотношение CD4+/CD8+ составляет в костном мозгу 0,5-1,0 (в крови 1,5-2,0). Миграция зрелых Т-лимфоцитов, а также части тимоцитов в костный мозг усиливается под влиянием гормонов коры надпочечников. В связи с этим содержание Т-клеток в костном мозгу увеличивается при стрессе. Физиологический смысл этого явления неясен; возможно, это связано с усилением процесса образования антител в костном мозгу вследствие миграции сюда Т-клеток, но это объяснение имеет отношение лишь к миграции СD4+-клеток.
В то же время для костного мозга характерна субпопуляция Т-клеток, имеющих фенотип CD3+CD4-CD8-. На их долю приходится 60% СDЗ+-клеток. Среди них 70-80% несут рецептор αβ-типа, а 20-30% — γδ-типа. Первые похожи на аналогичные клетки печени, но лишены (у мышей) маркера В220. Полагают, что они дифференцируются локально, минуя тимус.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 527; Нарушение авторских прав?; Мы поможем в написании вашей работы!