
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
КУРС ФИЗИКИ 7 страница
|
|
|
|
 (38.1)
(38.1)
где 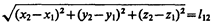 — расстояние между точками трехмерного пространства, в которых эти события произошли. Введя обозначение t 12 = t 2 – t 1, получим
— расстояние между точками трехмерного пространства, в которых эти события произошли. Введя обозначение t 12 = t 2 – t 1, получим

Покажем, что интервал между двумя событиями одинаков во всех инерциальных системах отсчета. Обозначив D t = t 2 – t 1, D x = x 2 – x 1, D y = y 2 – y 1 и D z = z 2 – z 1, выражение (38.1) можно записать в виде


Интервал между теми же событиями в системе К' равен
 (38.2)
(38.2)
Согласно преобразованиям Лоренца (36.3),

Подставив эти значения в (38.2), после элементарных преобразований получим, что  т. е.
т. е.
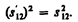
Обобщая полученные результаты, можно сделать вывод, что интервал, определяя пространственно-временные соотношения между событиями, является инвариантом при переходе от одной инерциальной системы отсчета к другой. Инвариантность интервала означает, что, несмотря на относительность длин и промежутков времени, течение событий носит объективный характер и не зависит от системы отсчета.
Теория относительности, таким образом, сформулировала новое представление о пространстве и времени. Пространственно-временные отношения являются не абсолютными величинами, как утверждала механика Галилея — Ньютона, а относительными. Следовательно, представления об абсолютном пространстве и времени являются несостоятельными. Кроме того, инвариантность интервала между двумя событиями свидетельствует о том, что пространство и время органически связаны между собой и образуют единую форму существования материи — пространство-время. Пространство и время не существуют вне материи и независимо от нее.
Дальнейшее развитие теории относительности (общая теория относительности, или теория тяготения) показало, что свойства пространства-времени в данной области определяются действующими в ней полями тяготения. При переходе к космическим масштабам геометрия пространства-времени не является евклидовой (т. е. не зависящей от размеров области пространства-времени), а изменяется от одной области к другой в зависимости от концентрации масс в этих областях и их движения.
§ 39. Основной закон релятивистской динамики материальной точки
Масса движущихся релятивистских частиц зависит от их скорости:
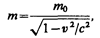 (39.1)
(39.1)
где m 0 — масса покоя частицы, т. е. масса, измеренная в той инерциальной системе отсчета, относительно которой частица находится в покое; с — скорость света в вакууме; т — масса частицы в системе отсчета, относительно которой она движется со скоростью v. Следовательно, масса одной и той же частицы различна в разных инерциальных системах отсчета.

Из принципа относительности Эйнштейна (см. § 35), утверждающего инвариантность всех законов природы при переходе от одной инерциальной системы отсчета к другой, следует условие инвариантности уравнений физических законов относительно преобразований Лоренца. Основной закон динамики Ньютона

оказывается также инвариантным по отношению к преобразованиям Лоренца, если в нем справа стоит производная по времени от релятивистского импульса.
Основной закон релятивистской динамики материальной точки имеет вид
 (39.2)
(39.2)
или
 (39.3)
(39.3)
где
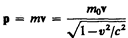 (39.4)
(39.4)
— релятивистский импульс материальной точки.
Отметим, что уравнение (39.3) внешне совпадает с основным уравнением ньютоновской механики (6.7). Однако физический смысл его другой: справа стоит производная по времени от релятивистского импульса, определяемого формулой (39.4). Таким образом, уравнение (39.2) инвариантно по отношению к преобразованиям Лоренца и, следовательно, удовлетворяет принципу относительности Эйнштейна. Следует учитывать, что ни импульс, ни сила не являются инвариантными величинами. Более того, в общем случае ускорение не совпадает по направлению с силой.
В силу однородности пространства (см. § 9) в релятивистской механике выполняется закон сохранения релятивистского импульса: релятивистский импульс замкнутой системы сохраняется, т. е. не изменяется с течением времени. Часто вообще не оговаривают, что рассматривают релятивистский импульс, так как если тела движутся со скоростями, близкими к с, то можно использовать только релятивистское выражение для импульса.
Анализ формул (39.1), (39.4) и (39.2) показывает, что при скоростях, значительно меньших скорости с, уравнение (39.2) переходит в основной закон (см. (6.5)) классической механики. Следовательно, условием применимости законов классической (ньютоновской) механики является условие v<<c. Законы классической механики получаются как следствие теории относительности для предельного случая v<<c (формально переход осуществляется при с ®¥). Таким образом, классическая механика — это механика макротел, движущихся с малыми скоростями (по сравнению со скоростью света в вакууме).
Экспериментальное доказательство зависимости массы от скорости (39.1) является подтверждением справедливости специальной теории относительности. В дальнейшем (см. § 116) будет показано, что на основании этой зависимости производятся расчеты ускорителей.
§ 40. Закон взаимосвязи массы и энергии
Найдем кинетическую энергию релятивистской частицы. Раньше (§ 12) было показано, что приращение кинетической энергии материальной точки на элементарном перемещении равно работе силы на этом перемещении:
 (40.1)
(40.1)
Учитывая, что dr = v d t, и подставив в (40.1) выражение (39.2), получаем
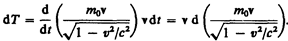
Преобразовав данное выражение с учетом того, что vdv = v d v, и формулы (39.1), придем к выражению
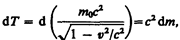 (40.2)
(40.2)
т. е. приращение кинетической энергии частицы пропорционально приращению ее массы.
Так как кинетическая энергия покоящейся частицы равна нулю, а ее масса равна массе покоя m 0, то, проинтегрировав (40.2), получим
 (40.3)
(40.3)
или кинетическая энергия релятивистской частицы имеет вид
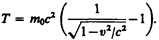 (40.4)
(40.4)
Выражение (40.4) при скоростях v«c переходит в классическое:

(разлагая в ряд  при v << c, правомерно пренебречь членами второго порядка малости).
при v << c, правомерно пренебречь членами второго порядка малости).
А. Эйнштейн обобщил положение (40.2), предположив, что оно справедливо не только для кинетической энергии частицы, но и для полной энергии, а именно любое изменение массы D m сопровождается изменением полной энергии частицы,
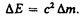 (40.5)
(40.5)
Отсюда А. Эйнштейн пришел к универсальной зависимости между полной энергией тела Е и его массой т:
 (40.6)
(40.6)
Уравнение (40.6), равно как и (40.5), выражает фундаментальный закон природы — закон взаимосвязи (пропорциональности) массы и энергии: полная энергия системы равна произведению ее массы на квадрат скорости света в вакууме. Отметим, что в полную энергию Е не входит потенциальная энергия тела во внешнем силовом поле.
Закон (40.6) можно, учитывая выражение (40.3), записать в виде
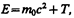

откуда следует, что покоящееся тело (T =0) также обладает энергией

называемой энергией покоя. В классической механике энергия покоя Е 0 не учитывается, считая, что при v =0 энергия покоящегося тела равна нулю.
В силу однородности времени (см. § 13) в релятивистской механике, как и в классической, выполняется закон сохранения энергии: полная энергия замкнутой системы сохраняется, т. е. не изменяется с течением времени.
Из формул (40.6) и (39.4) найдем релятивистское соотношение между полной энергией и импульсом частицы:
 (40.7)
(40.7)
Возвращаясь к уравнению (40.6), отметим еще раз, что оно имеет универсальный характер. Оно применимо ко воем формам энергии, т. е. можно утверждать, что с энергией, какой бы формы она ни была, связана масса
 (40.8)
(40.8)
и, наоборот, со всякой массой связана энергия (40.6).
Чтобы охарактеризовать прочность связи и устойчивость системы каких-либо частиц (например, атомного ядра как системы из протонов и нейтронов), вводят понятие энергии связи. Энергия связи системы равна работе, которую необходимо затратить, чтобы разложить эту систему на составные части (например, атомное ядро — на протоны и нейтроны). Энергия связи системы
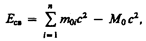 (40.9)
(40.9)
где m 0 i — масса покоя i -й частицы в свободном состоянии; М 0 — масса покоя системы, состоящей из п частиц.
Закон взаимосвязи (пропорциональности) массы и энергии блестяще подтвержден экспериментом о выделении энергии при протекании ядерных реакций. Он широко используется для расчета энергетических эффектов при ядерных реакциях и превращениях элементарных частиц.
Рассматривая выводы специальной теории относительности, видим, что она, как, впрочем, и любые крупные открытия, потребовала пересмотра многих установившихся и ставших привычными представлений. Масса тела не остается постоянной величиной, а зависит от скорости тела; длина тел и длительность событий не являются абсолютными величинами, а носят относительный характер; наконец, масса и энергия оказались связанными друг с другом, хотя они и являются качественно различными свойствами материи.
Основной вывод теории относительности сводится к тому, что пространство и время органически взаимосвязаны и образуют единую форму существования материи — пространство-время. Только поэтому пространственно-временной интервал между двумя событиями является абсолютным, в то время как пространственные и временны2е промежутки между этими событиями относительны. Следовательно, вытекающие из преобразований Лоренца следствия являются выражением объективно существующих пространственно-временны2х соотношений движущейся материи.
7.1. Определить собственную длину стержня (длину, измеренную в системе, относительно которой стержень покоится), если в лабораторной системе (системе отсчета, связанной с измерительными приборами) его скорость v = 0,8 с, длина l = 1 м и угол между ним и направлением движения q = 30°.

7.2. Собственное время жизни частицы отличается на 1,5% от времени жизни по неподвижным часам. Определить b = v / с. [0,172]
7.3. Тело, масса покоя которого 2 кг, движется со скоростью 200 Мм/с в системе K', перемещающейся относительно системы К со скоростью 200 Мм/с. Определить: 1) скорость тела относительно системы К; 2) его массу в этой системе. [1) 277 Мм/с; 2) 5,2 кг]
7.4. Воспользовавшись тем, что интервал — инвариантная величина по отношению к преобразованиям координат, определить расстояние, которое пролетел p-мезон с момента рождения до распада, если время его жизни в этой системе отсчета D t = 5 мкс, а собственное время жизни (время, отсчитанное по часам, движущимся вместе с телом) D t 0 =2,2 мкс. [1,35 км]
7.5. Определить скорость, при которой релятивистский импульс частицы превышает ее ньютоновский импульс в пять раз. [0,98 с]
7.6. Определить скорость, полученную электроном, если он прошел ускоряющую разность потенциалов 1,2 МэВ. [2,86 Мм/с]
7.7. Определить релятивистский импульс электрона, кинетическая энергия которого 1 ГэВ. [5,34×10–19 Н×с]
2 ОСНОВЫ МОЛЕКУЛЯРНОЙ ФИЗИКИ И ТЕРМОДИНАМИКИ
Глава 8 Молекулярно-кинетическая теория идеальных газов
§ 41. Статистический и термодинамический методы. Опытные законы идеального газа
Статистический и термодинамический методы исследования. Молекулярная физика и термодинамика — разделы физики, в которых изучаются макроскопические процессы в телах, связанные с огромным числом содержащихся в телах атомов и молекул. Для исследования этих процессов применяют два качественно различных и взаимно дополняющих друг друга метода: статистический (молекулярно-кинетический) и термодинамический. Первый лежит в основе молекулярной физики, второй — термодинамики.
Молекулярная физика — раздел физики, изучающий строение и свойства вещества исходя из молекулярно-кинетических представлений, основывающихся на том, что все тела состоят из молекул, находящихся в непрерывном хаотическом движении.
Идея об атомном строении вещества высказана древнегреческим философом Демокритом (460—370 до н. э.). Атомистика возрождается вновь лишь в XVII в. и развивается в работах М. В. Ломоносова, взгляды которого на строение вещества и тепловые явления были близки к современным. Строгое развитие молекулярной теории относится к середине XIX в. и связано с работами немецкого физика Р. Клаузиуса (1822—1888), Дж. Максвелла и Л. Больцмана.
Процессы, изучаемые молекулярной физикой, являются результатом совокупного действия огромного числа молекул. Законы поведения огромного числа молекул, являясь статистическими закономерностями, изучаются с помощью статистического метода. Этот метод основан на том, что свойства макроскопической системы в конечном счете определяются свойствами частиц системы, особенностями их движения и усредненными значениями динамических характеристик этих частиц (скорости, энергии и т. д.). Например, температура тела определяется скоростью хаотического движения его молекул, но так как в любой момент времени разные молекулы имеют различные скорости, то она может быть выражена только через среднее значение скорости движения молекул. Нельзя говорить о температуре одной молекулы. Таким образом, макроскопические характеристики тел имеют физический смысл лишь в случае большого числа молекул.
Термодинамика — раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями. Термодинамика не рассматривает микропроцессы, которые лежат в основе этих превращений. Этим термодинамический метод отличается от статистического. Термодинамика базируется на двух началах — фундаментальных законах, установленных в результате обобщения опытных данных.
Область применения термодинамики значительно шире, чем молекулярно-кинетической теории, ибо нет таких областей физики и химии, в которых нельзя было бы пользоваться термодинамическим методом. Однако, с другой стороны, термодинамический метод несколько ограничен: термодинамика ничего не говорит о микроскопическом строении вещества, о механизме явлений, а лишь устанавливает связи между макроскопическими свойствами вещества. Молекулярно-кинетическая теория и термодинамика взаимно дополняют друг друга, образуя единое целое, но отличаясь различными методами исследования.
Термодинамика имеет дело с термодинамической системой — совокупностью макроскопических тел, которые взаимодействуют и обмениваются энергией как между собой, так и с другими телами (внешней средой). Основа термодинамического метода — определение состояния термодинамической системы. Состояние системы задается термодинамическими параметрами (параметрами состояния) — совокупностью физических величин, характеризующих свойства термодинамической системы. Обычно в качестве параметров состояния выбирают температуру, давление и удельный объем.
Температура — одно из основных понятий, играющих важную роль не только в термодинамике, но и в физике в целом. Температура — физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. В соответствии с решением XI Генеральной конференции по мерам и весам (1960) в настоящее время можно применять только две температурные шкалы — термодинамическую и Международную практическую, градуированные соответственно в кельвинах (К) и в градусах Цельсия (°С). В Международной практической шкале температура замерзания и кипения воды при давлении 1,013×105 Па соответственно 0 и 100°С (реперные точки).
Термодинамическая температурная шкала определяется по одной реперной точке, в качестве которой взята тройная точка воды (температура, при которой лед, вода и насыщенный пар при давления 609 Па находятся в термодинамическом равновесии). Температура этой точки по термодинамической шкале равна 273,16 К (точно). Градус Цельсия равен кельвину. В термодинамической шкале температура замерзания воды равна 273,15 К (при том же давлении, что и в Международной практической шкале), поэтому, по определению, термодинамическая температура и температура по Международной практической шкале связаны соотношением
Т = 273,15 + t.
Температура T = 0 К называется нулем кельвин. Анализ различных процессов показывает, что 0 К недостижим, хотя приближение к нему сколь угодно близко возможно.
Удельный объем v — это объем единицы массы. Когда тело однородно, т. е. его плотность r = const, то v=V/m= 1 /p. Так как при постоянной массе удельный объем пропорционален общему объему, то макроскопические свойства однородного тела можно характеризовать объемом тела.
Параметры состояния системы могут изменяться. Любое изменение в термодинамической системе, связанное с изменением хотя бы одного из ее термодинамических параметров, называется термодинамическим процессом. Макроскопическая система находится в термодинамическом равновесии, если ее состояние с течением времени не меняется (предполагается, что внешние условия рассматриваемой системы при этом не изменяются).
В молекулярно-кинетической теории пользуются идеализированной моделью идеального газа, согласно которой считают, что:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Модель идеального газа можно использовать при изучении реальных газов, так как они в условиях, близких к нормальным (например, кислород и гелий), а также при низких давления» и высоких температурах близки по своим свойствам к идеальному газу. Кроме того, внеся поправки, учитывающие собственный объем молекул газа и действующие молекулярные силы, можно перейти к теории реальных газов.
Рассмотрим законы, описывающие поведение идеальных газов.
Закон Бойля—Мариотта *: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная:
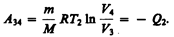 (41.1)
(41.1)
* Р. Бойль (1627—1691)—английский ученый; Э. Мариотт (1620—1684) — французский физик.
Кривая, изображающая зависимость между величинами р и V, характеризующими свойства вещества при постоянной температуре, называется изотермой. Изотермы представляют собой гиперболы, расположенные на графикетем выше, чем выше температура, при которой происходит процесс (рис. 60).
Законы Гей-Люссака *:1) объем данной массы газа при постоянном давлении изменяется линейно с температурой:
(41.2)
2) давление данной массы газа при постоянном объеме изменяется линейно с температурой:
(41.3)
* Ж. Гей-Люссак (1778—1850) — французский ученый.
В этих уравнениях t — температура по шкале Цельсия, р 0 и V 0 — давление и объем при 0°С, коэффициент a = 1/273,15 К–1.
Процесс, протекающий при постоянном давлении, называется изобарным. На диаграмме в координатах V, t (рис. 61) этот процесс изображается прямой, называемой изобарой. Процесс, протекающий при постоянном объеме, называется изохорным. На диаграмме в координатах р, t (рис. 62) он изображается прямой, называемой изохорой.
Из (41.2) и (41.3) следует, что изобары и изохоры пересекают ось температур в точке t=– 1 /a=– 273,15°С, определяемой из условия 1+a t = 0. Если перенести начало отсчета в эту точку, то происходит переход к шкале Кельвина (рис. 62), откуда
Вводя в формулы (41.2) и (41.3) термодинамическую температуру, законам Гей-Люссака можно придать более удобный вид:
(41.4)
(41.5)
где индексы 1 и 2 относятся к произвольным состояниям, лежащим на одной изобаре или изохоре.
Закон Авогадро *: моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы. При нормальных условиях этот объем равен 22,41×10–3 м3/моль.
* А. Авогадро (1776—1856) — итальянский физики химик.
По определению, в одном моле различных веществ содержится одно и то же число молекул, называемое постоянной Авогадро:

Закон Дальтона *: давление смеси идеальных газов равно сумме парциальных давлений p 1, p 2 ,..., рn входящих в нее газов:

Парциальное давление — давление, которое производил бы газ, входящий в состав газовой смеси, если бы он один занимал объем, равный объему смеси при той же температуре.
* Дж. Дальтон (1766—1844) — английский химик и физик.
§ 42. Уравнение Клапейрона — Менделеева
Как уже указывалось, состояние некоторой массы газа определяется тремя термодинамическими параметрами: давлением р, объемом V и температурой Т. Между этими параметрами существует определенная связь, называемая уравнением состояния, которое в общем виде дается выражением

где каждая из переменных является функцией двух других.
Французский физик и инженер Б. Клапейрон (1799—1864) вывел уравнение состояния идеального газа, объединив законы Бойля — Мариотта и Гей-Люссака. Пусть некоторая масса газа занимает объем V 1, имеет давление р 1 и находится при температуре T 1. Эта же масса газа в другом произвольном состоянии характеризуется параметрами р 2, V 2, T 2 (рис. 63). Переход из состояния 1 в состояние 2 осуществляется в виде двух процессов: 1) изотермического (изотерма 1–1'), 2) изохорного (изохора 1'–2).

В соответствии с законами Бойля — Мариотта (41.1) и Гей-Люссака (41.5) запишем:
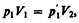 (42.1)
(42.1)
 (42.2)
(42.2)
Исключив из уравнений (42.1) и (42.2)  получим
получим

Так как состояния 1 и 2 были выбраны произвольно, то для данной массы газа величина pV/T остается постоянной, т. е.
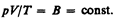 (42.3)
(42.3)
Выражение (42.3) является уравнением Клапейрона, в котором В — газовая постоянная, различная для разных газов.
Русский ученый Д. И. Менделеев (1834—1907) объединил уравнение Клапейрона с законом Авогадро, отнеся уравнение (42.3) к одному молю, использовав молярный объем V m. Согласно закону Авогадро, при одинаковых р и Т моли всех газов занимают одинаковый молярный объем V m, поэтому постоянная В будет одинаковой для всех газов. Эта общая для всех газов постоянная обозначается R и называется молярном газовой постоянной. Уравнению
 (42.4)
(42.4)
удовлетворяет лишь идеальный газ, и оно является уравнением состояния идеального газа, называемым также уравнением Клапейрона — Менделеева.
Числовое значение молярной газовой постоянной определим из формулы (42.4), полагая, что моль газа находится при нормальных условиях (р 0 = 1,013×105 Па, T 0=273,15 К, V m=22,41×10–3 м3/моль): R =8,31 Дж/(моль×К).
От уравнения (42.4) для моля газа можно перейти к уравнению Клапейрона — Менделеева для произвольной массы газа. Если при некоторых заданных давлении и температуре один моль газа занимает молярный объем V m, то при тех же условиях масса т газа займет объем V= (т/М)V m, где М — молярная масса (масса одного моля вещества). Единица молярной массы — килограмм на моль (кг/моль). Уравнение Клапейрона — Менделеева для массы т газа
 (42.5)
(42.5)
где n =m/M — количество вещества.

Часто пользуются несколько иной формой уравнения состояния идеального газа, вводя постоянную Больцмана:
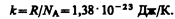
Исходя из этого уравнение состояния (42.4) запишем в виде

где N A /V m = n — концентрация молекул (число молекул в единице объема). Таким образом, из уравнения
 (42.6)
(42.6)
следует, что давление идеального газа при данной температуре прямо пропорционально концентрации его молекул (или плотности газа). При одинаковых температуре и давлении все газы содержат в единице объема одинаковое число молекул. Число молекул, содержащихся в 1 м3 газа при нормальных условиях, называется числом Лошмидта *:
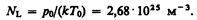
* И. Лошмидт (1821—1895) —австрийский химик и физик.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 503; Нарушение авторских прав?; Мы поможем в написании вашей работы!