
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория спектра атома водорода по Бору
|
|
|
|
В 1913 году Бор, используя резерфордовскую модель атома, гипотезу Планка и предложенные им постулаты, разработал теорию спектра водородоподобного атома – атома содержащего ядро с зарядом 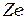 и один электрон, который движется вокруг ядра (например, ионы
и один электрон, который движется вокруг ядра (например, ионы  и
и 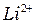 ). Если
). Если 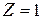 такая система соответствует атому водорода.
такая система соответствует атому водорода.
При рассмотрение движения электрона в водородоподобной системе, ограничимся круговыми стационарными орбитами.Согласно первому постулату Бора возможны только такие орбиты, для которых момент импульса электрона на этой орбите 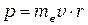 удовлетворяет условию:
удовлетворяет условию:
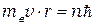 (
( = 1, 2, 3,). (4.1)
= 1, 2, 3,). (4.1)
Уравнение движения электрона (второй закон Ньютона 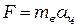 где
где 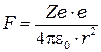 кулоновская сила,
кулоновская сила, 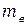 - масса электрона,
- масса электрона,  - центросремительное ускорение) имеет вид:
- центросремительное ускорение) имеет вид:
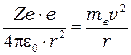 (4.2)
(4.2)
Выразив из (4.1) линейную скорость электрона  и подставив в (4.2) получим выражение для радиусов разрешённых орбит:
и подставив в (4.2) получим выражение для радиусов разрешённых орбит:
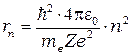 (
( = 1, 2, 3,). (4.3)
= 1, 2, 3,). (4.3)
Радиус первой орбиты водородоподобного атома 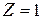 при
при 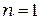 называется первым боровским радиусом:
называется первым боровским радиусом:
 = 5,28∙10-11 м = 0.529Å.
= 5,28∙10-11 м = 0.529Å.
Отметим, что боровский радиус  совпадает со значением газокинетических размеров атомов. Так как радиусы стационарных орбит измерить невозможно, необходимо вывести из теории такие величины которые поддаются экспериментальному определению. Такой величиной является энергия, излучаемая или поглощаемая атомами водорода.
совпадает со значением газокинетических размеров атомов. Так как радиусы стационарных орбит измерить невозможно, необходимо вывести из теории такие величины которые поддаются экспериментальному определению. Такой величиной является энергия, излучаемая или поглощаемая атомами водорода.
Внутренняя энергия атома слагается из кинетической энергии электрона (считаем ядро неподвижным) и энергии взаимодействия электрона с ядром
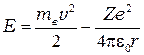 .
.
Из (4.2) следует
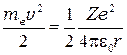 .
.
Следовательно
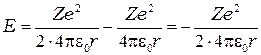
Подставив сюда выражение для радиуса стационарных орбит (4.3) найдём разрешённые значения внутренней энергии атома:
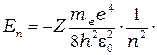 (
( = 1, 2, 3,….∞) (4.4)
= 1, 2, 3,….∞) (4.4)
где знак минус означает, что электрон находится в связанном состоянии.
Схема энергетических уровней определяемой формулой (4.4) приведена на рис.7.
Целое число  , определяющее энергетические уровни атома, называется главным квантовым числом. Энергетический уровень с
, определяющее энергетические уровни атома, называется главным квантовым числом. Энергетический уровень с  = 1 называется основным (нормальным) уровнем, а соответствующее ему состояние атома называется основным (нормальным) состоянием. Уровни с
= 1 называется основным (нормальным) уровнем, а соответствующее ему состояние атома называется основным (нормальным) состоянием. Уровни с  >1 и соответствующие им состояния называются возбуждёнными. Придавая
>1 и соответствующие им состояния называются возбуждёнными. Придавая  целочисленные значения, получаем для атома водорода энергетические уровни, или линейчатый спектр, представленный на рисунке. Минимальная энергия атома водорода: Е 1 = -13,55 эВ.
целочисленные значения, получаем для атома водорода энергетические уровни, или линейчатый спектр, представленный на рисунке. Минимальная энергия атома водорода: Е 1 = -13,55 эВ.
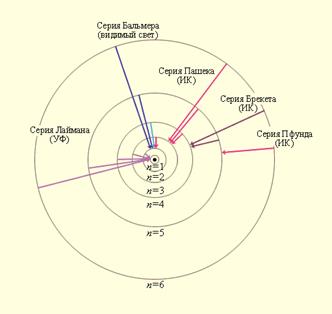
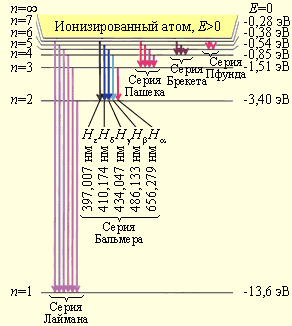
Рис. 7
Максимальная энергия электрона E ∞ = 0 при  = ∞ называется энергией ионизации атома (при Е = E ∞ происходит отрыв электрона от атома), то есть
= ∞ называется энергией ионизации атома (при Е = E ∞ происходит отрыв электрона от атома), то есть 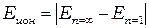 или
или
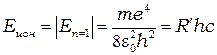
Переход из стационарного состояния  в стационарное состояние
в стационарное состояние 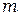 , согласно второму постулату Бора, сопровождается испусканием кванта света:
, согласно второму постулату Бора, сопровождается испусканием кванта света:
 .
.
Отсюда частота излучённого кванта
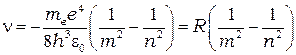 (4.5)
(4.5)
где
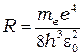 (4.6)
(4.6)
- теоретическое формула постоянной Ридберга.
Мы пришли к обобщённой формуле Бальмера. Теоретическое значение 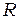 хорошо согласуется со значением постоянной Ридберга, определенным экспериментально.
хорошо согласуется со значением постоянной Ридберга, определенным экспериментально.
Теория Бора сыграла огромную роль в создании атомной физики, в развитии атомной и молекулярной спектроскопии, но её внутренняя противоречивость — соединение классических и квантовых представлений — не позволили на её основе объяснить спектры многоэлектронных атомов (даже простейшего из них — атома гелия, содержащего помимо ядра два электрона).
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 460; Нарушение авторских прав?; Мы поможем в написании вашей работы!