
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Как определить, связи какого типа образуют атомы элементов в определенном веществе? Рассмотрим примеры
1. Хлорид цезия CsCl. Атом цезия (IА группа) большой, с низким значением электроотрицательности, легко отдает электрон, а атом хлора (VIIА группа) небольшой с большим значением ЭО легко его принимает, следовательно, связь в хлориде цезия ионная (типичный металл с типичным неметаллом).
2. Гидрид азота (аммиак) NH3 Атомы азота (VА группа) и водорода (IА группа) отличаются по размерам – оба небольшие по размеру (неметаллы). По склонности принимать электроны они отличаются, связь в молекуле NH3 ковалентная полярная.
3. Азот N2. Простое вещество. Связываемые атомы одинаковые и при этом небольшие, следовательно, связь в молекуле азота ковалентная неполярная.
4. Кальций Са. Простое вещество. Связываемые атомы одинаковые и довольно большие, следовательно связь в кристалле кальция металлическая.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
61. Исходя из теории ковалентной связи, изобразите в виде валентных схем строение молекул: HCl, H2O, NH3.
62. Почему энергия двойной связи С = С (613,2 кДж) не равна удвоенному значению энергии одинарной связи С - С (348,6 кДж)?
63. Как изменяется полярность связи и прочность молекул в ряду HF, HCl, HBr, HI?
64. Какие химические связи имеются в ионах [NH4]+, [BF4]-?
65. Какую валентность, обусловленную не спаренными электронами (спин-валентность), может проявлять фосфор в нормальном и возбужденном состояниях?
66. Что такое гибридизация валентных орбиталей? Какое строение имеют молекулы типа АВn если связь в них образуется за счет sp-, sp 2 -, sp 3 – гибридизации орбиталей атома А?
67. Как метод молекулярных орбиталей (МО) описывает строение двухатомных гомоядерных молекул элементов, второго периода?
68. Пользуясь таблицей относительных электроотрицательностей, вычислить их разность для связей Н–О и О–Rb в гидроксиде RbОН и определить: а) какая из связей в молекуле характеризуется большей степенью ионности; б) каков характер диссоциации этих молекул в водном растворе.
69. Как изменяется прочность связи в ряду СO2–SiO2–GeO2–SnO2? Указать причины этих изменений.
70. Дипольный момент молекулы HCN равен 0,97×10-29 Кл×м. Определите длину диполя молекулы HCN. 
71. Какой вид гибридизации электронных облаков имеет место в атоме кремния при образовании молекулы SiF4? Какова пространственная структура этой молекулы?
72. Опишите с помощью метода молекулярных орбиталей молекулу Н20.
73. Определите тип гибридизации орбиталей центрального атома в частице Н3О+.Назовите и изобразите геометрическую форму этой частицы.
74. Определите тип гибридизации орбиталей центрального атома в частице NO2.Назовите и изобразите геометрическую форму этой частицы.
75. Укажите тип гибридизации орбиталей бора в молекуле BBr3.
76. Какие виды химической связи имеются в молекуле NH4I?
77. Сера образует химические связи с калием, водородом, бромом и углеродом. Какие из связей наиболее и наименее полярны? Укажите, в сторону какого атома происходит смещение электронного облака связи.
78. Описать с позиции метода МО молекулу ВеН2: определить кратность связи и магнитные свойства молекулы.
79. Описать с позиции метода МО молекулу СН4: определить кратность связи и магнитные свойства молекулы.
80. Определите тип гибридизации и геометрическую форму комплексного иона [MoCl4]2-
81. Определите тип гибридизации и геометрическую форму комплексного иона [ZnCl4]2-
82. С помощью метода валентных связей (ВС) опишите пространственное строение молекулы CO2.
83. Определите тип гибридизации и геометрическую форму комплексного иона [Cd(H2O)4]2+
84. С помощью метода валентных связей (ВС) опишите пространственное строение молекулы (NН4)+.
85. Определите тип гибридизации и геометрическую форму комплексного иона [Ni(OH)4]2-
86. С помощью метода валентных связей (ВС) опишите пространственное строение молекулы PF3.
87. Определите тип гибридизации и геометрическую форму комплексного иона [Co(NH3)4]3+.
88. С помощью метода валентных связей (ВС) опишите пространственное строение молекулы SiF4.
89. Определите тип гибридизации и геометрическую форму комплексного иона [Cr(H2O)4]3+
90. Определите тип гибридизации и геометрическую форму комплексного иона [CuCl4]2-
РАЗДЕЛ 4. ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.
Классификация сложных неорганических веществ.
Неорганические вещества делятся на четыре основных класса: оксиды, кислоты, основания, соли. Представим известные нам классы соединений в виде единой схемы:
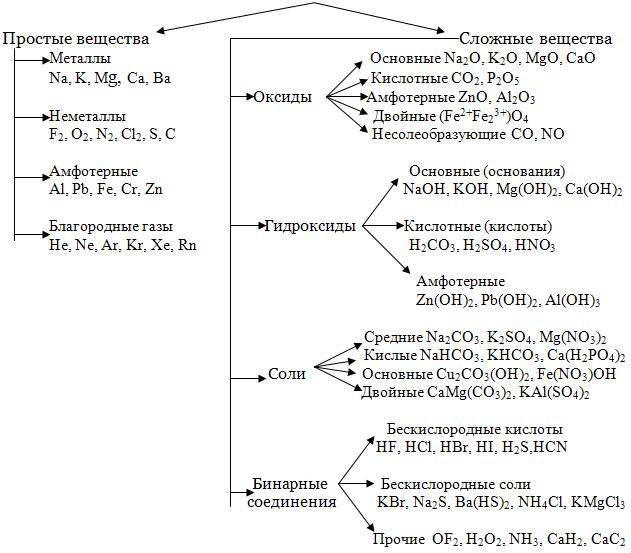
Деление веществ на классы достаточно условно. Например, мы знаем, что кислоты подразделяются на одно-, двух- и трехосновные, но их обычно не выделяют в отдельные классы соединений. Точно также не являются отдельными классами сильные и слабые кислоты. Это же справедливо и для оснований. Между классами существует важная связь, которую называют генетической. Эта связь заключается в том, что из веществ одного класса можно получить вещества других классов. Существует два основных пути генетических связей между веществами: один из них начинается металлами, другой – неметаллами. Например, сульфат кальция CaSO4 можно получить либо из металла кальция, либо другим путем – из неметалла серы:
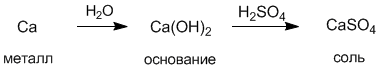
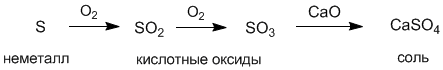
С другой стороны, из соли можно опять прийти к металлу и неметаллу:
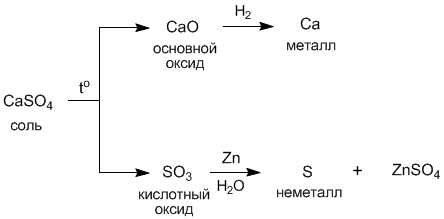
Одновременно существуют и другие пути взаимопревращений соединений разных классов. Таким образом, генетические связи между разными классами соединений очень многообразны.
Оксиды и их классификация.
Как мы уже знаем, оксиды бывают кислотные и основные. Это деление положено в основу их классификации.
Большинство кислотных оксидов хорошо реагирует с водой, давая кислоту. Например, кислый вкус простой газированной воды объясняется образованием угольной кислоты Н2СО3 из кислотного оксида СО2:
СО2 + Н2О = Н2СО3 (угольная кислота)
В простейших случаях формулу образующейся кислоты легко получить из формулы кислотного оксида простым сложением. Например:
| CO2 | + | H2O | = | H2CO3 |
| SO3 | + | H2O | = | H2CO3 |
Однако не все кислотные оксиды растворяются в воде, поэтому не все могут непосредственно с ней реагировать. Зато все кислотные оксиды реагируют с основаниями. При этом получается сразу соль. Например:
| SiO2 | + | H2O | = | реакция не идет |
| кислотный оксид (не растворим в воде) | вода |
| SiO2 | + | 2 NaOH | = | Na2SiO3 | + | H2O |
| кислотный оксид | щелочь | соль кремниевой кислоты H2SiO3 |
Полученную соль кремниевой кислоты можно превратить в саму кремниевую кислоту добавлением другой кислоты:
Na2SiO3 + 2 HCl = H2SiO3 + 2 NaCl
Таким образом, кислотному оксиду всегда соответствует определенная кислота:
CO2 (оксид углерода) – H2CO3 (угольная кислота);
SO3 (оксид серы VI) – H2SO4 (серная кислота);
SiO2 (оксид кремния) – H2SiO3 (кремниевая кислота).
Поскольку реакция с основаниями является общей для всех кислотных оксидов, им можно дать такое определение:
|
|
Дата добавления: 2014-11-07; Просмотров: 2028; Нарушение авторских прав?; Мы поможем в написании вашей работы!