
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидрокси-, галоген- и аминометилирование
|
|
|
|
Гидроксиметилированием (алкилированием) называется процесс замены атома водорода на гидроксиметильную (гидроксиалкильную) группу (–СН2ОН, –RСНОН). Это разновидность реакций С-, N-, О-алкилирования. Реагентом являются альдегиды. В реакцию вступают алифатические, ароматические и гетероциклические соединения.
Для С-гидроксиметилирования аренов используется формальдегид. Реакция идет только с активированными соединениями.
Фенол реагирует с формальдегидом в присутствии разбавленных кислот или щелочей. При этом в зависимости от условий реакции и соотношения реагентов образуется смесь салицилового и п- гидроксибензилового спирта, ди- и тригидроксиметилфенолов, а при взаимодействии гидроксиметилфенолов с фенолом и между собой — димеры и полимеры (бакелитовые лаки и фенолформальдегидная смола).
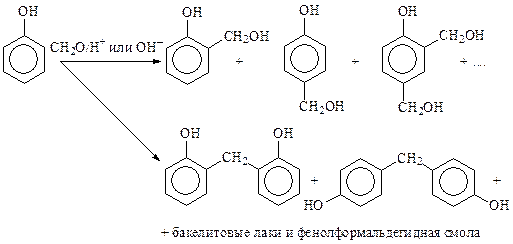
Реакцию можно рассматривать как электрофильное замещение в бензольное кольцо (механизм SE) или как нуклеофильное присоединение по С=О группе альдегида (AN):
В результате кислотного катализа формальдегид взаимодействует с кислотой, образуя активную электрофильную частицу — протонированный формальдегид, которая атакует бензольное кольцо и замещает протон:


В присутствии щелочи образуется фенолят ион и увеличивается электронное облако бензольного кольца, что также способствует электрофильному замещению:

С-Гидроксиметилирование алифатических соединений или в боковую цепь аренов реализуется лишь при наличии С–Н-кислотности.
В синтезе левомицетина используется кислотность α-С–Н связей кетона (1-(п -нитрофенил)-2-ацетиламино-1-этанона). При взаимодействии с основанием он образует нуклеофил, который присоединяется по С=О группе формальдегида, образуя гидроксиметильную группу:

В связи с этим альдольную конденсацию карбонильных соединений можно отнести к реакциям С-гидроксиалкилирования.
Аналогичные реакции идут с участием ацетилена за счет его С–Н- кислотности. Конденсация ацетилена с формальдегидом приводит к образованию 1,4-бутиндиола (синтезы гидроксибутирата натрия, ГАМК, поливинилпирролидона и др.):
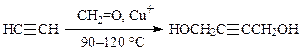
Гидроксиалкилирование ацетилена проходит при взаимодействии с кетонами в присутствии аммиака и металлического натрия, например, при синтезе изофитола в производстве витаминов Е и К:
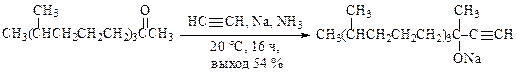
Примерами О- и N- гидроксиметилирования могут служить реакции формальдегида с полисахаридами (синтез полуацеталей) и амидами (нуклеофильное присоединение по С=О-группе альдегида), которые в ряде случаев используются для химической модификации полисахаридов, в том числе и биологически активными соединениями, а также в синтезе препарата никодин:


Замена атома водорода в молекулах органических соединений на галогенметильную группу (СН2Hlg) называется реакцией галогенметилирования. Она применяются в основном для получения «бензильных» галогенидов изароматических соединений. В качестве реагентов используются формальдегид и галогеноводород в присутствии катализатора.
При пропускании хлористого водорода через смесь ароматического углеводорода и формалина в присутствии хлорида цинка при температурах не более 50—60 °С образуются производные хлористого бензила (последовательно реализуются электрофильное и нуклеофильное замещение):

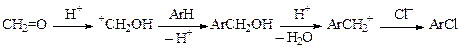
Получение хлористого бензила этим методом безопаснее и экологичнее хлорирования толуола. В готовом продукте отсутствуют примеси веществ, содержащих атом хлора в ароматическом ядре, что существенно важно в производстве пенициллина.
В качестве примера можно привести использование реакции хлорметилированияв синтезе адренергического препарата оксиметазолина:

В этом случае субстрат более активен, чем бензол, и реакцию можно вести в отсутствии апротонных кислот при температурах выше 90 °С. При этом образование побочного продукта диарилметана не наблюдается, т.к. протонные кислоты не катализируют алкилирование аренов галогенидами.
Хлорметилирование можно вести параформом в присутствии хлорсульфоновой кислоты (производство папаверина):
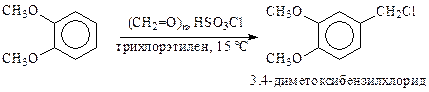
Аминометилированием называются реакции замены атома водорода в алифатических, ароматических и гетероциклических соединениях на аминометильную группу — СН2NRR’ (реакция Манниха). Реагентами являются формальдегид (иногда и другие карбонильные соединения) и амин. Однородный продукт реакции образуется лишь при использовании вторичных аминов. Реакция широко применяется в синтезе органических веществ, в том числе биологически активных соединений. Возможно С-, N-, O- и S- аминометилирование:

С-Аминоалкилирование аренов идет лишь с активированными соединениям, например, с фенолом (производство α-токоферола), фурфуриловым спиртом (синтезы ранитидина, лупитидина), N-метилпирролом (получение толметина) и индолом (синтез триптофана):

С-Аминоалкилирование алифатических соединений идет при наличии С–Н-кислотности субстрата. Аминометилирование кетонов (2-метилциклогексанона, ацетона) и производных ацетилена, применяется в производствах витамина А, молиндона и др. лекарственных субстанций:
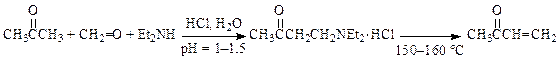
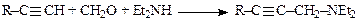
О-, N- или S-Аминоалкилирование проходит при использовании в реакции Манниха спиртов, аминов или тиолов:



Механизм реакции Манниха неоднозначен. Значительное влияние оказывают кислотность субстрата, нуклеофильность амина, значение рН среды, устойчивость основания Манниха.
Если используемый в реакции Манниха амин менее нуклеофилен, чем продукт взаимодействия С–Н-кислоты с основанием, то формальдегид реагирует преимущественно по типу альдольной конденсации и основание Манниха не образуется. Направление и ход реакции сильно зависят от кислотности среды.
ГЛАВА 7. ПРОЦЕССЫ АЦИЛИРОВАНИЯ
Замещение атома водорода или металла в молекуле органического соединения на ацильную группу называется реакцией ацилирования. Различают С-, N- и О-ацилирование. Условно они могут быть представлены следующей схемой:
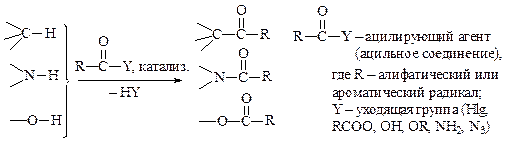
Ацилирующими агентами являются соединения общей формулы R–CO–Y, где R = алкил, арил, гетероциклический радикал; Y — уходящая группа = Hlg, R–COO-, OH, OR, NH2, NHR, NR2, а также N3. Кроме этого в качестве ацилирующих агентов используются кетен, дикетен и др.
Ацильная группа вводиться в молекулу органического вещества как с целью временной защиты лабильной группы (чаще всего –NH2), так и с целью изменения углеродного скелета молекулы и придания веществу новых свойств.
Ацилирование является одним из наиболее распространенных процессов в синтезе лекарственных веществ и витаминов, а также в синтезе пролекарств. Многие пролекарства содержат ацильные группы. В организме по мере деацилирования образуются вещества с большей биологической активностью, которые не могут быть введены в организм сразу в большой дозе из-за токсичности или по иным причинам (например, ацетилсалициловая кислота превращается в салициловую кислоту).
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 2296; Нарушение авторских прав?; Мы поможем в написании вашей работы!