
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Восстановление гидридами металлов
|
|
|
|
Гидриды металлов, особенно алюмогидрид лития(LiAlH4) и боргидрид лития LiBH4 или натрия NaBH4, обладают сильными восстановительными свойствами и используются для восстановления полярных соединений, имеющих двойные связи углерод–гетероатом.
Эти связи поляризованы и имеют частичный положительный заряд на атоме углерода, поэтому им характерны реакции присоединения С-, N- и О-нуклеофилов, которые в ряде случаев завершаются отщеплением уходящей группы. Рассматриваемые нами гидриды металлов могут играть роль Н-нуклеофила, как, например, металлоорганические соединения — С-нуклеофила, и отдавать гидрид-ион атому углерода, имеющему дефицит электронов.
Ниже приведен химизм реакции гидрида металла с карбонильной группой, которая идет особенно легко при восстановлении алюмогидридом лития альдегидов и кетонов до алкоголятов:

Перенос гидрид-иона осуществляется как синхронное расщепление связи металл–водород и образование С–Н-связи.
Последовательно в реакцию вступают все остальные атомы водорода гидрида, затем образовавшийся комплексный алкоголят лития и алюминия подвергается гидролитическому расщеплению:

Если в молекуле субстрата имеются «активные» водородные атомы, то алюмогидрид лития реагирует с ними в первую очередь, образуя водород.
Восстановление комплексными гидридами имеет важные преимущества по сравнению с другими методами: оно протекает, как правило, в очень мягких условиях и с высокими выходами. Этот метод особенно хорош при работе с ценными препаратами и с малыми количествами. Кроме того, он позволяет гладко восстанавливать малоактивные производные кислот.
Используя различные комплексные гидриды и растворители можно добиться высокой селективности восстановления.
|
|
|
Алюмогидрид лития — комплексное солеобразное соединение с формулой Li+AlH4–. Это белый мелкокристаллический очень гигроскопичный порошок. При контакте с водой он разлагается с выделением водорода. Алюмогидрид лития медленно растворяется в эфирах с образованием новых комплексов — эфиратов.
Алюмогидрид лития восстанавливает карбонильные соединения, карбоновые кислоты и все их кислород и галогенсодержащие производные до спиртов, азотсодержащие производные и алифатические нитросоединения — до аминов, а также галогениды и спирты — до углеводородов:
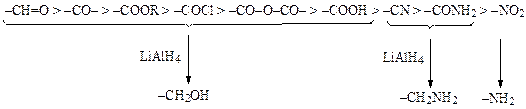

По легкости восстановления субстраты можно расположить в следующем порядке: альдегиды > кетоны > сложные эфиры > ангидриды кислот > кислоты > нитрилы > амиды > нитрогруппы. В литературе имеются и несколько другие данные о реакционной способности соединений.
Алюмогидрид лития восстанавливает практически все связи углерод–гетероатом, но не двойные связи углерод–углерод. Такая селективность позволяет восстановить функциональные группы в ненасыщенных углеводородах.
Добавление к алюмогидриду лития эквимолярного количества хлорида алюминия значительно увеличивает его восстанавливающее действие, что, по-видимому, связано с образованием гидрида алюминия и хлорида лития.
Восстановление алюмогидридом лития протекает в безводной среде, как правило, в эфире. Вместо диэтилового эфира в качестве растворителей можно использовать тетрагидрофуран, дибутиловый эфир, морфолин и др. Применение этих растворителей позволяет проводить восстановление при более высокой температуре, чем в диэтиловом эфире. Для увеличения растворимости субстрата эфиры иногда смешивают с бензолом или толуолом.
Работа с алюмогидридом лития требует особых мер предосторожности. Важно избегать контакта алюмогидрида лития с водой, так как это вызывает бурное разложение восстановителя с выделением воспламеняющегося в присутствии воздуха водорода. Тщательное обезвоживание растворителей является обязательным условием для работы с алюмогидридом лития.
|
|
|
В связи с тем, что с алюмогидридом лития можно работать только в безводной среде, в инертных органических растворителях, он непригоден для восстановления соединений, не растворяющихся в них, например, сахаров. В таких случаях хорошие результаты дает боргидрид натрия, который разлагается водой очень медленно.
В химико-фармацевтической промышленности алюмогидрид лития применяют:
а) для восстановления этилового эфира себациновой кислоты с лучшим выходом, чем в других методах (в синтезе противогрибкового препарата декамин)

б) в синтезе октадина

В синтезе нобриума алюмогидридом лития восстанавливают амид до вторичного амина (а), анальгетика диклофенака — карбоксильную группу до спирта (б), а:

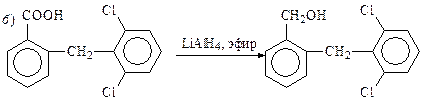
Боргидрид натрия является менее активным реагентом, чем алюмогидрид лития. Он обычно восстанавливает только хлорангидриды кислот, карбонильные соединения и основания Шиффа, но восстанавливает в таких полярных растворителях, как вода, метанол, пиридин, ацетонитрил.

Боргидрид натрия широко использует для избирательного восстановления альдегидов и кетонов в присутствии других функциональных групп:

При этом восстановление боргидридом натрия не затрагивает галоген, сложноэфирные группы, сульфамидные и др.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1722; Нарушение авторских прав?; Мы поможем в написании вашей работы!