
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Неэлектролиты и электролиты
|
|
|
|
Осмос. Осмотическое давление
Осмос – это односторонняя диффузия молекул растворителя через полупроницаемую мембрану.

Рис.5 Схема осмометра:
1 – вода;
2 – раствор;
3 – полупроницаемая мембрана
|
|
Росм. =См ∙R∙Т, кПа
Если концентрацию растворённого вещества выразить как молярную
С = n/V (число молей растворённого вещества в единице объёма), тогда
Росм ∙V = n∙R∙T или
Pосм = m ∙ R ∙ T/M ∙ V,
R=8,314 Дж/моль∙К (универсальная газовая постоянная)
Это уравнение совпадает с уравнением идеального газа, уравнением Менделеева-Клайперона. Поэтому Вант - Гофф пришёл к выводу, что осмотическое давление равно тому давлению, которое оказывало бы растворённое вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало тот же объём, что и раствор.
Одни вещества в растворённом или расплавленном состоянии проводят электрический ток (электролиты), другие в тех же условиях электрический ток не проводят (неэлектролиты).
Свойства растворов относятся к коллигативным свойствам, т.е. к таким свойствам, которые зависят от количества частиц в растворе. Рассчитанные теоретически значения Росм, DТкип, DТзам для электролитов не совпадают с экспериментальными.
Например: При растворении 1 моля хлорида натрия в 100г воды понижение температуры замерзания раствора составляла не 1,86о, а 3,36о, т.е. примерно в 2 раза больше теоретического значения.
Полученные экспериментальные данные приводят к выводу о распаде (диссоциации) молекул электролита в растворе на более мелкие частицы (ионы). Поэтому в уравнения законов Рауля и Вант-Гоффа был введен поправочный коэффициент ί, называемый изотоническим:
D Ткип = ί ∙ Е · Сm,
DТзам = ί ∙К · Сm,
(Р0 – Р) / Р0 = ί ∙NB,
Росм. = ί ∙См∙R∙Т.
Изотонический коэффициент для каждого раствора определяется экспериментально по изменению Pосм или ∆Тзам или ∆Ткип:
ί 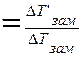 , где
, где
∆Т’- экспериментальное значение,
∆Т – теоретическое значение,
ί – зависит от природы растворенного вещества, концентрации.
С разбавлением раствора величина изотонического коэффициентаувеличивается.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 460; Нарушение авторских прав?; Мы поможем в написании вашей работы!