
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Внутренней энергией тела называют сумму кинетической энергии теплового движения его атомов и молекул и потенциальной энергии их взаимодействия между собой
|
|
|
|
Кипение – это интенсивный процесс испарения, происходящий по всему объёму жидкости и на её поверхности. Жидкость начинает кипеть, когда давление её насыщенного пара приближается к давлению внутри жидкости.
Пар – это газ, образованный испарившимися молекулами жидкости, и поэтому для него справедливо уравнение (23.7), связывающее давление пара, p, концентрацию молекул в нём, n и абсолютную температуру, T:
p = nkT. (27.1)
Из (27.1) следует, что давление насыщенного пара должно увеличиваться линейно с ростом температуры, как это имеет место у идеальных газов при изохорных процессах (см. §25). Однако, как показали измерения, давление насыщенного пара растёт с температурой гораздо быстрее, чем давление идеального газа (см. рис.27а). Происходит это из-за того, что с ростом температуры, а значит, и средней кинетической энергии, всё больше и больше молекул жидкости покидают её, увеличивая концентрацию, n пара над ней. А т.к. согласно (27.1) давление пропорционально n, то это увеличение концентрации пара и объясняет более быстрый рост давления насыщенного пара с температурой, по сравнению с идеальным газом. Рост давления насыщенных паров с температурой объясняет известный всем факт – при нагревании жидкости испаряются быстрее. Отметим, что, как только рост температуры приведёт к полному испарению жидкости, пар станет ненасыщенным, а зависимость его давления от температуры превратится в прямую, пересекающую ось абсцисс при T = 0 оС. (см. рис.27б).
Кипением называют образование большого числа пузырьков пара, всплывающих и лопающихся на поверхности жидкости при её нагревании. На самом деле, эти пузырьки присутствуют в жидкости всегда, но их размеры растут, и они становятся заметны только при кипении. Одна из причин того, что в жидкости всегда есть микропузырьки, следующая. Жидкость, когда её наливают в сосуд, вытесняет оттуда воздух, но полностью этого сделать не может, и маленькие его пузырьки остаются в микротрещинах и неровностях внутренней поверхности сосуда. Кроме того, в жидкостях обычно содержатся микропузырьки пара и воздуха, прилипшие к мельчайшим частицам пыли.
При нагревании жидкости в каждом из пузырьков процесс испарения ускоряется, а давление насыщенного пара растёт. Пузырьки расширяются и под действием выталкивающей силы Архимеда отрываются от дна, всплывают и лопаются на поверхности. При этом пар, наполнявший пузырьки, уносится в атмосферу. Поэтому кипение и называют испарением, происходящим во всём объёме жидкости. Кипение начинается при той температуре, когда пузырьки газа имеют возможность расширяться, а это происходит, если давление насыщенного пара превышает атмосферное давление. Таким образом, температура кипения – это температура, при которой давление насыщенного пара данной жидкости равно атмосферному давлению. Пока жидкость кипит её температура остаётся постоянной.
Чем меньше атмосферное давление, тем при более низкой температуре кипит данная жидкость (см. рис.27в). Так, на вершине горы Эльбрус, где давление воздуха в два раза меньше нормального, обычная вода кипит не при 100 оС, а при 82 оС. Наоборот, если необходимо повысить температуру кипения жидкости, то её нагревают при повышенном давлении. На этом, например, основана работа скороварок, где еда, содержащая воду, может вариться при температуре более 100 оС, не закипая.
Даже при нормальном атмосферном давлении разные жидкости кипят при разных температурах, например, ацетон – при 56 оС, а этиловый спирт при 78 оС. Температура кипения железа – 2800 оС, а вольфрама – 6000 оС. То, что жидкости кипят при разных температурах, используется в получении различных нефтепродуктов из нефти путём её нагревания, т.к. весь бензин, например, испаряется из нефти раньше, чем масла и мазут.
Процесс кипения невозможен без участия архимедовой выталкивающей силы. Поэтому на космических станциях в условиях невесомости кипения нет, а нагрев воды приводит только к увеличению размеров пузырьков пара и их объединению в один большой паровой пузырь внутри сосуда с водой.
Вопросы для повторения:
· Как давление насыщенных и ненасыщенных паров зависит от температуры?
· Что такое кипение, и при какой температуре оно происходит?
· Как зависит температура кипения от атмосферного давления?

Рис. 27. (а)- зависимость давления насыщенного водяного пара от температуры; (б) – зависимость давления водяного пара от температуры до (слева от синего пунктира) и после того, как вся вода испарилась; (в) – жидкость, кипящая на горелке (слева), остывшая (середина) и закипающая вновь при уменьшении давления воздуха в колбе (справа).
28. ВНУТРЕННЯЯ ЭНЕРГИЯ ТЕЛА. ФОРМУЛА ДЛЯ ВНУТРЕННЕЙ ЭНЕРГИИ ИДЕАЛЬНОГО ГАЗА.
Во многих случаях механическая энергия тела, являющаяся суммой его кинетической и потенциальной энергии (см. §17), изменяется. Например, мяч, катящийся по полю, замедляется, а сосулька, упавшая с крыши, разбивается о землю и превращается в несколько неподвижных осколков. Когда мяч катится по полю, он преодолевает силу трения, совершая работу, в результате чего его кинетическая энергия уменьшается на величину совершённой работы, а вместе с ней – и скорость. Работа против силы трения приводит к различным деформациям вдоль траектории мяча, его нагреву, а также к нагреву всего того, чего он касался при движении. Механическая энергия ударившейся о землю сосульки частично расходуется на работу, необходимую для того, чтобы расколоть ее на куски, а остальная часть энергии тратится на деформацию этих осколков и участка земли, на который они упали. Ну, а если эти осколки скользили по земле прежде, чем остановиться, то часть механической энергии превратилась и в тепло.
Так как энергия не может исчезать или возникать из неоткуда, то уменьшение механической энергии движущегося мяча и падающей сосульки означает, что механическая энергия переходит в какой-то другой вид энергии, зависящий от внутреннего состояния тела – его температуры, энергии связи между его частями и т.п. Этот вид энергии тела называют его внутренней энергией.
Внутренняя энергия тела увеличивается при нагреве, так как с ростом температуры кинетическая энергия молекул тоже растёт. Вторым слагаемым внутренней энергии является потенциальная энергия связей между частицами тела, т.к. эти частицы притягиваются друг к другу, чем и обеспечивается его целостность (рис. 28). Поэтому, внутреннюю энергию тела можно изменить, если сжать, растянуть или даже раздробить его, совершая, таким образом, работу над телом.
Однако внутренняя энергия тела зависит не только от его температуры, действующих на него сил и степени раздробленности. При плавлении, затвердевании, конденсации и испарении, т.е. при изменении агрегатного состояния тела, потенциальная энергия связи между его атомами и молекулами тоже изменяется, а значит, изменяется и его внутренняя энергия. Кроме того, внутренняя энергия может изменяться, когда вещество, из которого состоит тело, вступает в химическую (или ядерную) реакцию, в результате чего химическая структура вещества (или структура атомного ядра) изменяется и его внутренняя энергия – тоже.
Очевидно, что внутренняя энергия тела должна быть пропорциональна его объёму и равна сумме кинетической и потенциальной энергии всех молекул и атомов, из которых состоит это тело. К сожалению, для большинства веществ величины кинетической и потенциальной энергии молекул неизвестны, и поэтому вычислить значение внутренней энергии соответствующих тел не представляется возможным. В то же время, идеальный газ устроен очень просто и состоит из молекул, не взаимодействующих между собой, а значит, потенциальная энергия из взаимодействия равна нулю. Поэтому внутренняя энергия идеального газа равна кинетической энергии теплового движения его атомов или молекул и может быть вычислена довольно просто следующим образом.
Пусть газ одноатомный, т.е. состоит из отдельных атомов, а не молекул, например, любой из инертных газов. Тогда кинетическая энергия атомов этого газа равна кинетической энергии их поступательного движения, так как вращательное отсутствует. Поэтому для вычисления внутренней энергии, U одноатомного газа массы m необходимо умножить среднюю кинетическую энергию, ЕСР его атома (см. 23.6) на общее количество, N атомов в газе (см. 19.1 и 19.2):
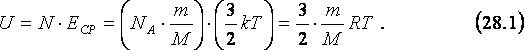
Как следует из (28.1), внутренняя энергия идеального газа прямо пропорциональна его абсолютной температуре и не зависит от других макроскопических параметров газа – его давления и объёма. Таким образом, сжимая газ в изотермических условиях, мы не изменяем его внутренней энергии.
Вопросы для повторения:
· Дайте определение внутренней энергии тела?
· Как внутренняя энергия зависит от агрегатного состояния и температуры?
· Как зависит внутренняя энергия идеального газа от его температуры, давления и объёма.

Рис. 28. Схематическое изображение внутренней энергии воды в стакане, состоящей из кинетической энергии движения её молекул (верх) и потенциальной энергии из взаимодействия (низ).
§ 29. КОЛИЧЕСТВО ТЕПЛОТЫ. УДЕЛЬНАЯ ТЕПЛОЁМКОСТЬ, ТЕПЛОТА ПЛАВЛЕНИЯ И ПАРООБРАЗОВАНИЯ.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 833; Нарушение авторских прав?; Мы поможем в написании вашей работы!