
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 2. 1.3. Распределение примесей между паром и водой
|
|
|
|
1.3. Распределение примесей между паром и водой
Соотношение между концентрациями (активностями) в жидкоу и паровой фазах является величиной постоянной, которая не зависит от количества (концентрации) вещества, растворенного в фазах. Эта постоянная получила название коэффициент распределения
Кс = Сіп / Сіж, (1.6)
где Сіп - концентрация примеси в паре;
Сіж - концентрация примеси в жидкости.
Действителььный коэффициент распределения зависит от температуры (давления) и воспроизводится уравнениями:
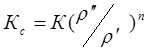 . (1.7)
. (1.7)
Или в логарифмичной форме (1.7) имет вияд:
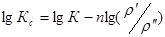 . (1.8)
. (1.8)
Где n – также называют координационным числом.
Графическая интерпретация этого уравнения называется лучевой диаграммой.
В практических условиях концентрация примесей в паровой фазе оказывается более высокой, чем это вытекает из (1.7). Это происходит вследствие того, что кипение происходит в динамическом равновесии и причем в потоке пара, который захватывает капли жидкости и заносит с ними в пар примеси. Образованию брызг и капель способствует разрыв поверхностной пленки паровых пузырей в момент их выхода из поверхности раствора.
Таким образом, вынос влаги в пар ведет к росту концентрации примесей в ней "механическим" путём, без какого либо способа растворения этих примесей. Поэтому на практике используют ещё одно понятие: практического или реального коэффициента распределения:
Ксд = Сіпд / Сіжо , (1.9)
где Сіжо – общая концентрация примесей в жидкости, с учетом суспензии, шлама и других форм присутствия твердых примесей (Сіжо = Сіж + Сісусп.);
Сіпд -общая концентрация в паре с учетом примесей, которые виносяться из влагой (Сіпд = ω Сіжо + Сіп). Здесь ω – влажность пара.
В развернутом виде (1.9) имеет вид:
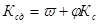 . (1.10)
. (1.10)
Здесь φ ≤ 1 - коэффициент, который учитывает долю истинно растворимых примесей в жидкости по отношению к общему количествупримесей, в том числе и в виде суспензии и др.
1.4. Растворимость в воде газов.
При оценке растворимости газов следует различать: химически инертные газы (О2, Н2,N2 )и химически активные газы, которые взаимодействуют с водой(СО2, NН3...).
У газов первой группы растворимость относительно невелика, у газов другой группы растворимость больше на несколько порядков. Процесс растворения газов называют абсорбцией, а обратный процесс - десорбцией. Для воздуха это – аэрация и деаэрация.
На отличие от твердого вещества, которое всегда при растворении находится под уровнем жидкости, газы образуют с жидкостью із четкую границу раздела (зеркало) и в условиях равновесия, как правило располагаютсяся над поверхностью жидкости, в газопаровом состоянии, т.е. в смеси газов и паров жидкости. Таким образом, когда говорят о растворимости газов в воде, то имеют в виду найбольшую возможную концентрацию этого газа в жидкости в условиях равновесия этого раствора из газовой фазой. Природа этого равновесия несколько иная чем твердых примесей, поскольку кроме температуры, следует брать во внимание и давление газа над раствором (парциіальное давление), в то время как для твердых примесей оно равно 0.
С точки зрения химической термодинамики в основе этого равновесия сохраняется общее условие: равенство химических потенциалов компонентов в кождой фазе.
На основе этих представлений, выражая химпотенциалы через концентрации (парциальные давления), получаем уравнение виразити растворимости газа:
Sμi= Pi / Kг, (1.11)
где Рi – парциальное давление газа над раствором;
Кг – константа Генри.
Само выражение известно в литературе как закон Генри.
Чтобы не зависеть от единиц концентраций на практике удобнее использовть не константу Генри, а так называемый коэффициент абсорбции
α = Vг/Vр,,
где Vг - объем газа, который растворен в воде, взятый при 0 оС и 1 бар;
Vр - объем жидкости, обычно это также объем раствора.
Используя это понятие, выражение для растворимости (моль/л) приобретает вид
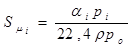 , (1.12)
, (1.12)
где αі - коэффициент абсорбции;
ρ - плотность раствора (воды), кг/л (г/см3);
Po – атмосферное давление (1бар);
Pi - парциальное давление газового компонента над раствором, в тех же единицах, что і Ро.
Данные о αі –содержатся в справочной литературе, в том числе – учебнике по ВХР.
Растворимость химически активних газов имеет свои
особенности и закон Генри применим к ним только для первого приближения.
Углекислый газ (СО2) очень распространен и содержится в природных источниках воды, а также во всех водных средах АЭС. Появление СО2 в воде возможно, как вследствие его растворения так и в связи с смещением равновесия между карбонатными и ихнем разложением. Имеется прямая связь между концентрацией СО2 и рН.
Приближенная связь между рН и концентрацией СО2 при 20 оС передается соотношением:
рН ≈ 5,5 - 0,5 lgС, (1.13)
где С - концентрация СО2 в мг/л.
Более точное соотношение рН и СО2 и температуры наводиться в литературе.
Растворимость аммиака. Аммиак является одним из наиболее распространенных коррегирующих агентов, которые используются для поддержания ВХР АЭС. Он, как и СО2, является также химически активным, реагирует с водой, но выявляет не кислотные, а щелочные свойства.
Аммиак при низких температурах диссоциирует достаточно активно и существенно влияет на рН, может его повысить, но при температурах более 300 оС он практически не диссоциирует, Поэтому увеличивать рН в таких условиях за счет аммиака нецелесообразно из-за излишне большую его потребность.
Учитывая большое значение для водных потоков АЭС равновесия в растворах, которые содержат СО2 и аммиак (системы NH3 -CO2 - H2O), запишемо аналитическое выражение этого равновесия равновесия
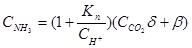 , (1.14)
, (1.14)
где K N - постоянная равновесия (закона действующих масс) при восстановлении иона аммиака, моль/л;
CН+ = 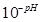 - концентрация ионов водорода, моль/л;
- концентрация ионов водорода, моль/л;
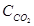 - концентрация СО2, моль/л;
- концентрация СО2, моль/л;
δ і β - коэффициенты, которые зависят от температуры и рН.
Аналитическое выражение этих коэффициентов такой:
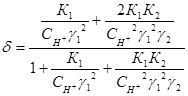 , (1.15)
, (1.15)
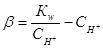 , (1.16)
, (1.16)
В этих уравнениях К1, К2, γ1, γ2, Кw – соответственно константы диссоциации угольной кислоты, коэффициенты активности одно и двухвалентных ионов, ионное произведение воды. Все эти величины зависят от температуры и могут быть рассчитаны по уравнениям, которые рассматривались ранее.
1.5. Коррозионные процессы и их интенсивность
Основные показатели коррозии:
- действительная и средняя скорости коррозии в мг/(м2 ч)
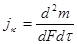 и
и 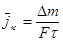 ,
,
где m - масса металла, который прокорродировал;
F – поверхность, м2;
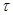 - промежуток времени, ч;
- промежуток времени, ч;
- глубинный показатель, который показывает толщину или глубину проникновения коррозии в толщу металла, он пригоден и для равномерной коррозии и для язв, вкраплений, трещин,‑ 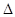 l, мм/год.
l, мм/год.
Связь между этими показателями

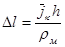 , (1,17)
, (1,17)
где h - число часов, на протяжении которых происходила коррозия за год, ч/год.
На коррозию влияет много факторов.
Влияние температуры для наиболее употребительной в энергетике конструкционной стали 20 получена линейная зависимость:
 , (1.18)
, (1.18)
где t - температура, оС;
jк - скорость коррозии, г/(м2 ч).
Соотношение справедливо при свободном доступе кислорода.
Для условий замкнутого пространства с ограниченным доступом кислорода возможно использовать соотношение (мои обобщения опытов Акользина):
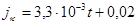 , (1.19)
, (1.19)
jк - скорость коррозии, г/(м2 ч).
Коррозия стали перлитного класса, которые используются для изготовления экранов котлов (nХМФ) и рассматриваются как перспективне материалы для АЭС, при температурах више 200 оС [12] описывается формулой:
 , (1.20)
, (1.20)
jк - скорость коррозии, мг/(м2 ч).
Для аустенитных сталей типа 1Х18Н10Т по данным Герасимова (моя обработка):
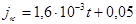 , (1.21)
, (1.21)
jк - скорость коррозии, мг/(м2 ч).
У перспективной стали (технологичной и более дешевой) 08Х14МФ скорость примерно в два раза выше чем по (1.21).
Влияние концентрации кислорода при значительных концентрациях линейно-пропорционально: чим больше кислорода, тем существеннее проявляют себя коррозионные процессы. Інтесификация коррозии имеет место также при одновременном содержании в воде других примесей, поскольку они ускоряют растворение продуктов коррозии и их виход в воду. В очень чистой воде (удельная электропроводность меньше чем 0,1 мкСм/см) небольшое количество кислорода может быть полезной. При концентрациях кислорода 200 – 400 мкг происходит пассивация поверхности стали. На ней образуется устойчивая магнетитовая пленка, которая снижает скорость коррозии.
Для всех металлов, которые исползуются в энергетике, характерна экстремальная зависимость скорости коррозии от рН. Металлы не стойкие при низких и высоких рН. Для железа минимальна интенсивность коррозии имеет место при значеннях рН в интервале 10-11, для меди около нейтрального значения. Такой характер влияния рН объясняется тем, что в кислой и щелочной областях образуются более благоприятные условия для растворения продуктов коррозии и возможность образования и сохранения пассивирующей пленки невысока.
Присутствие СО2 в теплоносителях АЭС не желательно, потому что ведет к образования кислой среды и интенсификации коррозии. Поскольку растворы СО2 имеют буферные свойства, то это еще сильнее влияет на устойчивую во времени коррозию. Особенно неблагоприятные условия возникают при одновременном повышении температуры. Наличие в воде углекислого газа плохо влияет также на чугуны, которые при повышенной температуре графитозируются и теряют прочность, они становятся хрупкими.
Стойкость против коррозии очень зависит от состава металла. В энергетике наиболее распространены углеродистые стали, частично легированные стали перлитного класса, а также в ответственных конструкциях дорогие высоколегированные аустенитные стали. почти все оборудование, особенно корпусы, является сталь 20. Ёё коррозионная стойкость не высока, при взаимодействии с водным теплоносителем скорость коррозии имеет порядок 102 мг/(м2 ч).
Перлитные низколегированные стали идут на изготовление экранов котлов (стали, що содержат хром, молибден и вольфрам), барабанов котлов и корпусов реакторов (16 ГНМ, 48ТС). Для них порядок скорости коррозии – 10 мг/(м2 ч).
Аустенитные высоколегированные стали 1Х18Н10Т, 12Х18Н12Т, 08Х18Н10Т и другие используются почти везде на АЭС, в последнее время также в подогревателях низкого давления. Для них скорость коррозии 1-2 мг/(м2 ч). Еще на порядок меньше скорость коррозии циркониевых сплавов.
1.6. Особенности и закономерности образования отложений (накипи).
Количественная оценка накипеобразования может осуществляться по показателям:
δ - толщине м,или мм;
J - удельной массе, г/м2;
jo - скоростью отложений, г/(м2 ч).
Статистические материалы ВТИ и др. организаций обработаны в виде:
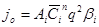 , (1.22)
, (1.22)
где jo - скорость (плотность) отложений, мг/(м2 ч);
Аі – коэффициент, который зависит от вида накипи;
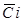 - средняя концентрация примеси, мг/л;
- средняя концентрация примеси, мг/л;
βі - поправочный множитель;
q - плотность теплового потока, Вт/м2;
n - показатель степени.
На основе данных о скорости отложений рассчитывается межпромывочный период
 , (1.23)
, (1.23)
где Jmax - максимально допустимая величина отложений в г/м2;
ji - скорость отложений і-го компонента для наиболее напряженного елемента, мг/(м2 ч).
Вопросы для самопроверки:
1. Что такое рН раствора?
2.Сформулируйте закон действующих масс и запишите его математическое выражение для процесса диссоциации воды.
3.Что такое удельная электропроводность, чем она определяется в растворах и какова ёё зависимость от температуры и концентрации?
4.Перчислите показатели ВР и поясните ихнее отношение к процессам накипеобразования и коррозии.
5.К акое содержание имеет понятие координационное число?
6.Какой характер имеет растворимость силикатов и меди при сверхкритическом состоянии воды?
7.Как возможно рассчитать растворимость железа?
8.Почему концентрация примесей в паре в реальных условиях отличается от равновесных условий?
9.Как влияет влажность пара на распределение примесей?
10.Какую функцию выполняют сепараторы?
11.Какая особенность растворения аммиака в воде?
12.Приведите зависимость степени диссоциации аммиака от температуры.
13.Приведите выражение дозы аммиака, которая обеспечивает необходимую величину рН теплоносителя.
14.Что такое первичное накипеобразования и какие условия его протекания?
15.Какие условия протекания вторичного накипеобразования?
16.Приведите классификацию накипей.
17.Какие параметры являются основными при накипеобразовании?
18.Приведите обобщенную зависимость скорости накипеобразования,
19.Как возможно рассчитать продолжительность межпромывочного периода?
20.К каким последствиям приводит появление отложений на поверхности нагрева?
21.К каким негативным результатам ведет коррозия оборудования АЭС?
22.В чём состоят основные задачи организации водно-химических режимов АЭС?
23.Каким законом определяется распределение примесей между паром и водой в равновесных условиях?
24.Что такое лучевая диаграмма и какое ее содержание?
25. В чём отличие растворимости газов в воде от растворимости твердых примесей?
26.Поясните явление коррозии металлов и факторы, которые его определяют.
27.Запишите уравнения скорости коррозии углеродистых и легированных сталей.
28.Перечислите и обоснуйте факторы, которые влияют на скорость коррозии металлов.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 2559; Нарушение авторских прав?; Мы поможем в написании вашей работы!