
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Данные опыта и результаты расчетов. Любая реакция нейтрализации сильной кислоты щелочью сводится к процессу Н+ + ОН‾ → Н2О
|
|
|
|
Выполнение работы
Любая реакция нейтрализации сильной кислоты щелочью сводится к процессу Н+ + ОН‾ → Н2О.
Для определения теплового эффекта реакции можно воспользоваться упрощенным калориметром, состоящим из трех стаканов – внешнего и двух внутренних.
В сухой внутренний стакан калориметра с помощью мерного цилиндра налить 25 мл 1 н. раствора щелочи. В другой сухой стакан налить 25 мл 1 н. раствора серной кислоты. Опустить в раствор щелочи термометр. Записать температуру и, не вынимая термометр из стакана, быстро влить кислоту в щелочь. Осторожно помешивая раствор термометром, отметить и записать максимальную температуру. Эту температуру считать конечной.
Требования к результатам работы
Полученные данные занести в табл. 3.1.
Таблица 3.1
| Температура Т, К | Изменение энтальпии ∆ Н, кДж | ∆ Н° нейтр.практ., кДж/моль | ∆ Н° нейтр. теор., кДж/моль | Относит. ошибка опыта Е, % | |
| началь-ная | конечная | ||||
Вычислить (все вычисления пояснить словами):
1. Изменение энтальпии реакции ∆ Н по формуле Δ H = −V∙ ρ ∙c∙ Δ Т,
где V – общий объем раствора, мл; ρ– плотность раствора, г/мл; с – теплоемкость раствора, Дж/(г∙К); Δ Т – разность между конечной и начальной температурами. Принять плотность раствора после нейтрализации равной 1г/мл, а теплоемкость его − равной теплоемкости воды, т. е. 4,18 Дж/(г∙К).
2. Тепловой эффект реакции нейтрализации ∆ Н° нейтр.практ. в расчете на 1 моль эквивалентов кислоты. Так как 1 моль эквивалентов кислоты содержится в 1 л (1000 мл) раствора, а для реакции было взято 25 мл, то
Δ H нейтр.практ. =  .
.
3. Теоретическое значение изменение энтальпии реакции нейтрализации ∆ Н° нейтр. теор для уравнения Н+ + ОН‾ → Н2О.
Энтальпии образования (Δ f Н°) для Н+, ОH‾ и Н2О соответственно равны 0; –230,2 и –285,8 кДж/моль.
4. Относительную ошибку опыта Е (%):
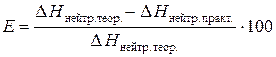 .
.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 663; Нарушение авторских прав?; Мы поможем в написании вашей работы!