
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения задач. Данные опыта и результаты расчетов Номер пробирки Температура t, °С Время τ
|
|
|
|
Данные опыта и результаты расчетов
| Номер пробирки | Температура t, °С | Время τ, с | Относительная скорость, V =100/τ | g | gср. |
| g1 | |||||
| g2 | |||||
1. Рассчитать относительную скорость реакции по соотношению
V = 100/τ.
2. Вычислить температурный коэффициент скорости реакции g, разделив
V 2 на V 1 и V 3 на V 2. Найти среднее значение
gср. =  .
.
3. Выразить графически зависимость скорости реакции от температуры, откладывая на оси абсцисс температуру, а на оси ординат – относительную скорость. Проходит ли кривая через начало координат и почему?
4. Сделать вывод о зависимости скорости химической реакции от температуры.
Пример 4.1. Как изменится скорость реакции каждой из реакций:
2NO (г) + Cl2 (г) = 2NOCl (г); (1);
СаО (к) + СО2 (г) = СаСО3 (к), (2),
если в каждой системе увеличить давление в 3 раза?
Решение. Реакция (1) гомогенная и, согласно закону действия масс, начальная скорость реакции равна 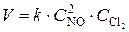 ; реакция (2) гетерогенная, и ее скорость выражается уравнением
; реакция (2) гетерогенная, и ее скорость выражается уравнением 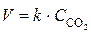 . Концентрация веществ, находящихся в твердой фазе (в данной реакции СаО), не изменяется в ходе реакции, поэтому не включается в уравнение закона действия масс.
. Концентрация веществ, находящихся в твердой фазе (в данной реакции СаО), не изменяется в ходе реакции, поэтому не включается в уравнение закона действия масс.
Увеличение давления в каждой из систем в 3 раза приведет к уменьшению объма системы в 3 раза и увеличению концентрации каждого из реагирующих газообразных веществ в 3 раза. При новых концетрациях скорости реакций рассчитываются по формулам:
 (1) и
(1) и  (2).
(2).
Сравнивая выражения для скоростей V и V', находим, что скорость реакции (1) возрастает в 27 раз, а реакции (2) – в 3 раза.
Пример 4.2. Реакция между веществами А и В выражается уравнением
2А + В = D. Начальные концентрации составляют (моль/л): СА = 5, СВ = 3,5. Константа скорости равна 0,4. Вычислить скорость реакции в начальный момент и в тот момент, когда в реакционной смеси останется 60 % вещества А.
Решение. По закону действия масс  . В начальный момент скорость V 1= 0,4×52×3,5 = 35. По истечении некоторого времени в реакционной смеси останется 60 % вещества А, т. е. концентрация вещества А станет равной 5×0,6 = 3 моль/л. Значит, концентрация А уменьшилась на 5−3 = 2 моль/л. Так как А и В взаимодействуют между собой в соотношении 2:1, то концентрация вещества В уменьшилась на 1 моль и стала равной 3,5 – 1 = 2,5 моль/л.
. В начальный момент скорость V 1= 0,4×52×3,5 = 35. По истечении некоторого времени в реакционной смеси останется 60 % вещества А, т. е. концентрация вещества А станет равной 5×0,6 = 3 моль/л. Значит, концентрация А уменьшилась на 5−3 = 2 моль/л. Так как А и В взаимодействуют между собой в соотношении 2:1, то концентрация вещества В уменьшилась на 1 моль и стала равной 3,5 – 1 = 2,5 моль/л.
Следовательно, V 2 = 0,4×32×2,5 = 9.
Пример 4.3. Через некоторое время после начала реакции 2NO + O2 = 2NO2 концентрации веществ составляли (моль/л):  = 0,06;
= 0,06;  = 0,12;
= 0,12;  = 0,216. Найти исходные концентрации NO и O2.
= 0,216. Найти исходные концентрации NO и O2.
Решение. Исходные концентрации NO и O2 находим на основе уравнения реакции, согласно которому на образование 2 моль NO2 расходуется 2 моль NO. По условию задачи образовалось 0,216 моль NO2, на что израсходовалось 0,216 моль NO. Значит, исходная концентрация NO равна
 = 0,06 + 0,216 = 0,276 моль/л.
= 0,06 + 0,216 = 0,276 моль/л.
По уравнению реакции на образование 2 моль NO2 необходимо 1 моль О2, а для получения 0,216 моль NO2 требуется 0,216/2 = 0,108 моль О2. Исходная концентрация О2 равна  = 0,12 + 0,108 = 0,228 моль/л.
= 0,12 + 0,108 = 0,228 моль/л.
Таким образом, исходные концентрации составляли:
 = 0,276 моль/л;
= 0,276 моль/л;  = 0,228 моль/л.
= 0,228 моль/л.
Пример 4.4. При 323 К некоторая реакция заканчивается за 30 с. Определить, как изменится скорость реакции и время ее протекания при 283 К, если температурный коэффициент скорости реакции равен 2.
Решение. По правилу Вант-Гоффа находим, во сколько раз изменится скорость реакции: 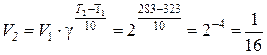 .
.
Скорость реакции уменьшается в 16 раз. Скорость реакции и время ее протекания связаны обратно пропорциональной зависимостью. Следовательно, время протекания данной реакции увеличится в 16 раз и составит 30×16 = 480 с = 8 мин.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1058; Нарушение авторских прав?; Мы поможем в написании вашей работы!