
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретическое введение. Цель работы: изучить понятия «коррозия металлов», «химическая и электрохимическая коррозия», способы защиты металлов от коррозии
|
|
|
|
Коррозия металлов
Лабораторная работа 12
Цель работы: изучить понятия «коррозия металлов», «химическая и электрохимическая коррозия», способы защиты металлов от коррозии.
Задание: провести опыты и выявить влияние образования гальванической пары на процесс растворения металла в кислоте; роль оксидной пленки в ослаблении коррозии; защитные свойства катодных и анодных покрытий. Выполнить требования к результатам опытов, оформить отчет, решить задачу.
Коррозией называется самопроизвольное разрушение металлов под воздействием окружающей среды. По механизму протекания коррозионного процесса различают химическую и электрохимическую коррозию.
Химической коррозией называется окисление металла, не сопровождающееся возникновением в системе электрического тока. Такой механизм наблюдается при взаимодействии металлов с агрессивными газами при высокой температуре (газовая коррозия) и жидкими неэлектролитами (коррозия в неэлектролитах).
Электрохимической коррозией называется разрушение металла в среде электролита, сопровождающееся возникновением внутри системы электрического тока. Электрохимическая коррозия протекает по механизму действия гальванического элемента. На поверхности металла одновременно протекают два процесса:
анодный – окисление металла:
М – nē → Mn+,
катодный – восстановление окислителя:
Ox + nē → Red.
Наиболее распространенными окислителями при электрохимической коррозии являются молекулы O2 воздуха и ионы H+ электролита. Восстановление на катоде молекул О2 и ионов Н+ протекает по уравнениям:
O2 + 2H2O + 4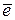 = 4OH‾ − в щелочной или нейтральной среде,
= 4OH‾ − в щелочной или нейтральной среде,
2H+ + 2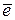 = H2 − в кислой среде.
= H2 − в кислой среде.
Металлы, применяемые в технике, содержат примеси других металлов, поэтому при соприкосновении с раствором электролита на их поверхности образуется большое количество непрерывно действующих микрогальванических элементов. Разрушается более активный металл. Например, при контакте железа с медью в присутствии электролита – соляной кислоты – возникает гальванический элемент:
(анод) (−) Fe | HCl | Cu (+) (катод)
и происходит электрохимическая коррозия.
На аноде идет процесс окисления: Fe0 − 2ē = Fe2+
На катоде – процесс восстановления: 2H+ + 2ē = H2
В результате железо разрушается в месте контакта, а на меди выделяется водород.
При контакте железа с медью во влажном воздухе образуется гальванический элемент (−) Fe | H2O, О2 | Cu (+) и процесс коррозии выражается уравнениями:
на аноде Fe0 − 2ē = Fe2+
на катоде O2 + 2H2O + 4ē = 4OH‾
 |
2Fe + O2 + 2H2O = 2Fe(OH)2.
Под влиянием кислорода воздуха гидроксид железа (II) окисляется по уравнению: 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3. Далее Fe(OH)3 частично теряет воду и превращается в ржавчину.
Одним из важнейших методов защиты металлов от коррозии являются защитные покрытия металлов, которые изолируют металл от внешней среды и могут быть неметаллическими (лаки, краски, эмали) и металлическими. Различают катодные и анодные металлические покрытия. Покрытие защищаемого металла менее активным металлом называется катодным, например, луженое железо. Покрытие защищаемого металла более активным называется анодным, например, оцинкованное железо. В случае нарушения целостности покрытий и наличия раствора электролита разрушается более активный металл. Так, в случае хромированного железа (анодное покрытие) будет разрушаться хром: (−) Cr | HCl | Fe (+)
на аноде Cr0 − 3ē = Cr3+
на катоде 2H+ + 2ē = H2.
В случае никелированного железа (катодное покрытие) разрушается железо: (−) Fe | HCl | |Ni (+)
на аноде Fe0 − 2ē = Fe2+
на катоде 2H+ + 2ē = H2.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 545; Нарушение авторских прав?; Мы поможем в написании вашей работы!