
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Постулати н. Бора
|
|
|
|
ПЛАН
1 Явища що, підтверджують складність будови атома.
2 Перші моделі атома.
3 Досліди Резерфорда.
5 Спектральні закономірності випромінювання атома гідрогену.
6 Випромінювання та поглинання світла атомом. Неперервний і лінійчатий спектри. Спектральний аналіз. Лазер.
1 ЯВИЩА, ЩО ПІДТВЕРДЖУЮТЬ СКЛАДНІСТЬ БУДОВИ АТОМА
До 70-х років XIX ст. під атомами розуміли неподільні частинки речовини. Проте під кінець XIX ст. стали відомі факти, які свідчили, що атом — складна електрична система. Електризація тіл тертям, проходження струму через рідини і гази показали, що до складу атомів входять заряджені частинки. У 1897 р. Дж. Томсон відкрив електрон і виміряв його питомий заряд. Дослідження відкритого в 1896 р. А. Беккерелем радіоактивного випромінювання свідчило, що з атомів радіоактивних речовин вилітають позитивно — 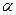 і негативно —
і негативно — 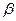 заряджені частинки та
заряджені частинки та  -проміння.
-проміння.
2 ПЕРШІ МОДЕЛІ АТОМА
 На початку ХХ-го століття визнаною була модель будови атома Томсонів (Уільяма і Джозефа), що образно називалась «кекс з ізюмом». Згідно неї, в атом у вигляді позитивно зарядженої кульки радіусом ~ 10-10м вкраплено окремі електрони, що нейтралізують позитивний заряд. Електрони, коливаючись, випромінюють світло. У 1901 р. французький фізик Ж. Перрен висловив припущення про наявність згущення в центрі атома. Інші вчені вважали, що він може мати кілька оболонок, утворених вкрапленими електронами. Нарешті в 1904р. японський фізик X. Нагаока запропонував планетарну модель атома, згідно з якою навколо позитивної центральної частини обертаються електрони, подібно до того, як це відбувається з кільцями Сатурна. Але на цю пропозицію не звернули уваги.
На початку ХХ-го століття визнаною була модель будови атома Томсонів (Уільяма і Джозефа), що образно називалась «кекс з ізюмом». Згідно неї, в атом у вигляді позитивно зарядженої кульки радіусом ~ 10-10м вкраплено окремі електрони, що нейтралізують позитивний заряд. Електрони, коливаючись, випромінюють світло. У 1901 р. французький фізик Ж. Перрен висловив припущення про наявність згущення в центрі атома. Інші вчені вважали, що він може мати кілька оболонок, утворених вкрапленими електронами. Нарешті в 1904р. японський фізик X. Нагаока запропонував планетарну модель атома, згідно з якою навколо позитивної центральної частини обертаються електрони, подібно до того, як це відбувається з кільцями Сатурна. Але на цю пропозицію не звернули уваги.
3 ДОСЛІДИ Е. РЕЗЕРФОРДА — досліди, проведені в лабораторії Резерфорда його учнями по розсіюванню пучка 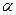 - частинок під час проходження їх через тонку металеву фольгу.
- частинок під час проходження їх через тонку металеву фольгу.
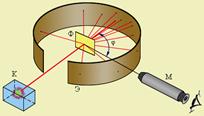 Надзвичайно велику швидкість
Надзвичайно велику швидкість 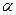 - частинок (до 20000 м/с) Е. Резерфорд вирішив використати для дослідження структури атомів методом обстрілу мікронної товщини фольги золота і платини потоком цих частинок. Схема установки показана на рисунку. Присутність
- частинок (до 20000 м/с) Е. Резерфорд вирішив використати для дослідження структури атомів методом обстрілу мікронної товщини фольги золота і платини потоком цих частинок. Схема установки показана на рисунку. Присутність 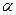 - частинок визначали за
- частинок визначали за
допомогою екрану, вкритого сірчистим цинком, який світився від їх ударів.
 Вже перші експерименти 1911 р. вразили Е. Резерфорда:
Вже перші експерименти 1911 р. вразили Е. Резерфорда:
а) більшість 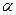 - частинок пролітали не відхиляючись крізь «суцільну» (у кілька тисяч шарів атомів) перешкоду так, наче вона була дірявіша від старого решета;
- частинок пролітали не відхиляючись крізь «суцільну» (у кілька тисяч шарів атомів) перешкоду так, наче вона була дірявіша від старого решета;
б) менша частина їх кількості відхилялась на невеликі кути;
в) окремі частинки розсіювались на великі (до 180°) кути.
Особливості результатів експерименту привели вченого до думки, що:
1) діаметр «- частинок менший у ~105 разів від попередніх
уявлень;
2) електрони не викликають розсіювання, бо їх маси в 8 тис. разів менші за масу 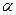 - частинки;
- частинки;
3 )в атомі повинно існувати ядро, в якому зосереджена майже вся маса атома і розміри якого дуже малі (10-15 м);
4) заряд ядра позитивний і дорівнює Zе, де Z — порядковий номер елемента, що дорівнює кількості електронів в атомі; е — елементарний заряд.
На основі цих висновків було запропоновано ядерну модель атома: в центрі атома позитивно заряджене ядро, розмір якого становить 10-15 м, а навколо нього в сфері діаметром =10-10м по орбітах рухаються електрони (їх кількість Z). Модель атома подібна до Сонячної системи, тому її часто називають планетарною.
4 ПОСТУЛАТИ Н. БОРА. За законами класичної електродинаміки, електрони рухаючись по замкнених орбітах, мають доцентрове прискорення, а отже повинні випромінювати електромагнітні хвилі. Енергія електрона при цьому зменшується і врешті він, рухаючись по спіралі, має впасти на ядро. Наближаючись до ядра, електрон повинен частіше обертатись (зберігаючи швидкість сталою), а значить повинна неперервно зростати частота випромінювання, тобто спектр — суцільний. Насправді атоми — дуже стійкі системи і мають лінійчасті, а не суцільні спектри випромінювання.
Рятуючи ситуацію, Н. Бор у 1913р. ввів ідеї квантової теорії в ядерну модель Резерфорда і розробив теорію атома Гідрогену, яка повністю підтвердилась експериментально.
В основі його теорії лежать два основні положення — постулати:
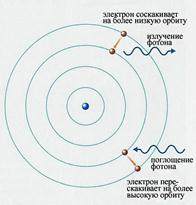 1. Атомна система може існувати тільки в особливих стаціонарних чи квантових станах, кожному з яких відповідає визначена енергія Еп в стаціонарному стані атом не випромінює.
1. Атомна система може існувати тільки в особливих стаціонарних чи квантових станах, кожному з яких відповідає визначена енергія Еп в стаціонарному стані атом не випромінює.
Умова квантування має вигляд
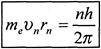 , де те— маса електрона,
, де те— маса електрона, 
vп — швидкість електрона на n -й орбіті та її радіус.
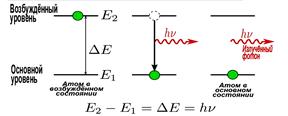
 2. Атом випромінює або поглинає квант електромагнітної енергії при переході електрона з одного стаціонарного стану в інший.
2. Атом випромінює або поглинає квант електромагнітної енергії при переході електрона з одного стаціонарного стану в інший.
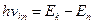 Енергія кванта дорівнює різниці енергій стаціонарних станів електрона:
Енергія кванта дорівнює різниці енергій стаціонарних станів електрона:
5 СПЕКТРАЛЬНІ ЗАКОНОМІРНОСТІ ВИПРОМІНЮВАННЯ АТОМА ГІДРОГЕНУ. Постулати Бора дозволяють визначити частоти випромінювання атомів водню під час переходу між різними станами. Усі частоти випромінювань атома водню складають низку серій, кожна з яких утворюється під час переходу атома з одного енергетичного стану в інший.
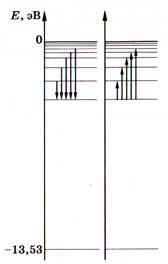
 Електрон міцно зв'язаний з ядром і для його віддалення від ядра необхідно виконати роботу (тим більшу, чим менше число п). Отже, повна енергія електрона в атомі — від'ємна. Для іонізації гідрогену з основного стану п= 1 необхідно витратити енергію
Електрон міцно зв'язаний з ядром і для його віддалення від ядра необхідно виконати роботу (тим більшу, чим менше число п). Отже, повна енергія електрона в атомі — від'ємна. Для іонізації гідрогену з основного стану п= 1 необхідно витратити енергію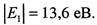 . У цьому стані атом може перебувати як завгодно довго, а електронна оболонка має сферичну симетрію. Стани n >1 називають збудженими і час перебування атома у них дуже малий. Збуджений стан п= 2 відповідає асиметричній будові електронної хмаринки, а
. У цьому стані атом може перебувати як завгодно довго, а електронна оболонка має сферичну симетрію. Стани n >1 називають збудженими і час перебування атома у них дуже малий. Збуджений стан п= 2 відповідає асиметричній будові електронної хмаринки, а
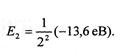 .
.
При n = 3

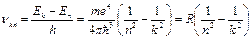 Коли електрони переходять з нижчих енергетичних рівнів на вищі, атом поглинає енергію, а коли навпаки — випромінює. Частота випромінювання обчислюється за формулою:
Коли електрони переходять з нижчих енергетичних рівнів на вищі, атом поглинає енергію, а коли навпаки — випромінює. Частота випромінювання обчислюється за формулою: 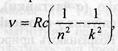 ,
,
 Де
Де

 — стала Рідберга, с — швидкість світла, n і k — номери стаціонарних станів. При цьому можуть випромінюватись серії ліній, названі іменами вчених, що їх досліджували.
— стала Рідберга, с — швидкість світла, n і k — номери стаціонарних станів. При цьому можуть випромінюватись серії ліній, названі іменами вчених, що їх досліджували.
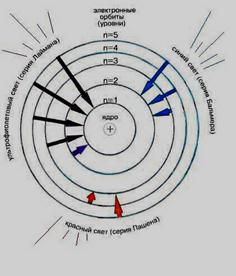
Спектральні серії водню:
Серія Лаймана – відкрив в 1906 г. Теодор Лайман. Дана серія утворюється при переходах электронів із збуждених энергетичних рівней на перший в спектрі випромінювання і з першого рівня на всі інші при поглинанні.
Серія Бальмера – відкрив в 1885 г. Иоганн Бальмер. Дана серія утворюється при переходах электронів із збуждених энергетичних рівней на другий в спектрі випромінювання і з другого рівня на всі інші при поглинанні.
Серія Пашена – відкрив в 1908 г. Фридрих Пашен. Дана серія утворюється при переходах электронів із збуждених энергетичних рівней на третій в спектрі випромінювання і з третього рівня на всі інші при поглинанні.


6 ВИПРОМІНЮВАННЯ ТА ПОГЛИНАННЯ СВІТЛА АТОМОМ. НЕПЕРЕРВНИЙ І ЛІНІЙЧАТИЙ СПЕКТРИ. СПЕКТРАЛЬНИЙ АНАЛІЗ. ЛАЗЕР. Якщо світло випромінюють розріджені гази, то атоми газу знаходяться так далеко один від одного, що не чинять ніякого впливу на випромінювання сусідніх атомів, і у спектрі такого джерела будуть спостерігатись лише певні лінії. Цей спектр називають лінійчастим спектром.
Якщо світло випромінюють тверді тіла, рідини чи дуже сильно стиснені гази, то на випромінювання кожного з атомів суттєво впливають сусідні атоми. Унаслідок цього можна спостерігати розмивання ліній в спектрі випромінювання і плавний перехід від одного кольору до іншого. Так виглядає суцільний спектр.
 Лінійчастий спектр кожного хімічного елемента є індивідуальним. Цю властивість використовують для спектрального аналізу сполук, оскільки кожний атом цього елемента в його складі випромінює свої лінії, які не зливаються з лініями інших елементів. Цю речовину обов'язково потрібно перевести в газоподібний стан і дуже нагріти, щоб вона світилась. Прилади, які використовують для спектрального аналізу, називають спектрографами.
Лінійчастий спектр кожного хімічного елемента є індивідуальним. Цю властивість використовують для спектрального аналізу сполук, оскільки кожний атом цього елемента в його складі випромінює свої лінії, які не зливаються з лініями інших елементів. Цю речовину обов'язково потрібно перевести в газоподібний стан і дуже нагріти, щоб вона світилась. Прилади, які використовують для спектрального аналізу, називають спектрографами.
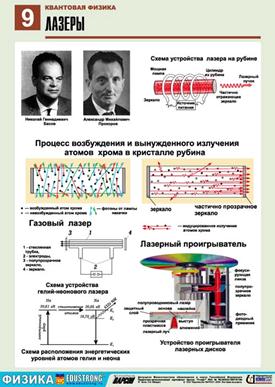
Лазер - це одне з найбільших досягнень сучасної фізики. Він випромінює впорядковане світло, всі фотони якого мають однакову напруженість Е; і не виникає різниця фаз між коливаннями. Це призводить до того, що результуюче значення напруженості поля у світлі лазера є настільки велике, що можна відірвати електрон від атома, нагріти середовище до температури випаровування.
Принцип дії першого лазера на кристалі рубіна такий: під час проходження електромагнітної хвилі крізь речовину, її енергія поглинається. За рахунок поглинутої енергії хвилі частина атомів переходить у збуджений стан (вищий енергетичний стан). Енергія світлового пучка при цьому дорівнює: hn = E2 – E1.


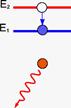
Збуджений атом може віддати свою енергію сусіднім атомам під час зіткнення чи випромінити фотон у будь-якому напрямі.
У разі збудження великої частини атомів електромагнітна хвиля частотою: буде підсилюватися внаслідок індукованого випромінювання. Під її дією атоми узгоджено переходять на нижчі енергетичні рівні, випромінюючи хвилі, які збігаються за частотою і фазою із падаючою хвилею.
Є різні методи утворення середовища із збудженими станами атомів. У рубіновому лазері (рис.) використовують для цього спеціальну потужну газорозрядну лампу, що має форму спіралі і дає синьо-зелене світло.
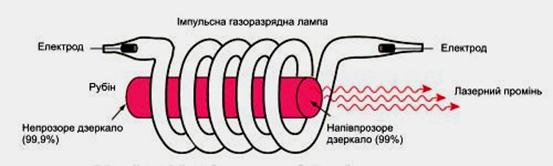
Атоми збуджуються внаслідок поглинання світла. Але двох рівнів енергії для роботи лазера недостатньо. Яким би потужним не було світло лампи, кількість збуджених атомів буде не більшою від незбуджених. Бо світло одночасно збуджує атоми і спричинює індуковані переходи з верхнього рівня на нижній. Вихід було знайдено у використанні трьох енергетичних рівнів. Потрібні енергетичні рівні мають кристали рубіну. Рубін - це яскраво червоний кристал оксиду алюмінію Al2O3 з домішкою атомів хлору (близько 0,05%). Саме рівні іонів хлору в кристалі мають потрібні властивості.
На рівні 3 система "живе" дуже мало, приблизно 10-8с, після цього самовільно без випромінювання переходить до стану 2 (енергія при цьому передається кристалічним гратам). Перехід від стану 2 до стану 1 під впливом зовнішньої електромагнітної хвилі супроводиться випромінюванням, що й використовується у лазерах. Після спалаху потужної лампи система переходить до стану 2 і через проміжок часу близько до 10-8 с переходить до стану 3, в якому "живе" порівняно довго (приблизно 10-3с). Так забезпечується "перенаселеність" збудженого рівня 2 порівняно з не збудженим рівнем 1.
Унаслідок самовільних переходів 2-1 випромінюються хвилі різних напрямів. Ті з них, які йдуть під кутом до осі кристала, виходять з нього і для наступних процесів не мають ніякого значення. Але хвиля, що проходить вздовж осі кристала, багато разів відбивається від його торців. Вона зумовлює випромінювання збуджених іонів хрому і швидко підсилюється. Через один із торців стрижня (напівпрозорий) виходить потужний короткочасний імпульс червоного світла.
Лазерне випромінювання має такі властивості:
- лазери здатні створювати пучки світла з дуже малим кутом розбіжності;
- світло лазера є монохроматичним;
- лазер є найпотужнішим джерелом світла.
Лазери використовують для: зв'язку в космосі, випаровування чи зварювання матеріалів у вакуумі, в хірургічних операціях (офтальмологія), збудження хімічних реакцій, здійснення керованої термоядерної реакції та ін.

Газовий лазер на CO2 довжиною кілька метрів

Рідинний лазер
 Напівпровідникові лазери
Напівпровідникові лазери
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 1480; Нарушение авторских прав?; Мы поможем в написании вашей работы!