
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Розрахунок кількості тепла, яке потрібно підвести або відвести від апарату
|
|
|
|
ТЕПЛОВІ РОЗРАХУНКИ
Теплові розрахунки виконують з метою визначення кількості тепла, яке необхідно підвести або відвести для здійснення процесу, обчислення поверхні теплообміну і витрат теплоносіїв і холодоагентів.
Як і у попередніх матеріальних, технологічних розрахунках, необхідно враховувати організаційний характер процесу, оскільки тепловий баланс для періодичного процесу складають по-іншому, ніж для безперервного.
Для періодичного процесу теплові розрахунки і тепловий баланс складають на одну операцію за прийнятим або заданим температурним постадійним графіком роботи апарату, наприклад:

Рис. 6.1 Температурний графік роботи апарату
I теплова стадія - підігрів вихідних речовин від 20о до 60оС;
II теплова стадія - зона хімічної реакції при додаванні реагенту при постійній температурі;
ІІІ теплова стадія - зона підігріву від 60о до 80оС;
ІV теплова стадія - зона витримки при 80оС;
V теплова стадія - зона охолодження від 80о до 20оС.
Для кожної теплової стадії (зони) складають рівняння теплового балансу. З нього визначають кількість тепла, яку необхідно підвести до апарату (або відвести), витрати теплоносія або холодоагенту. За максимальним тепловим навантаження визначають розрахункову поверхню теплообміну.
Рівняння теплового балансу має вигляд:
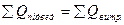 ,
,
або
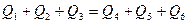 ,
,
де 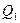 - тепло, що вноситься в апарат з вихідними речовинами, кДж;
- тепло, що вноситься в апарат з вихідними речовинами, кДж;
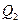 - тепло, що підводиться теплоносієм або відводиться холодоагентом, кДж;
- тепло, що підводиться теплоносієм або відводиться холодоагентом, кДж;
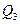 - тепловий ефект процесу, кДж;
- тепловий ефект процесу, кДж;
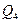 - тепло, що виноситься з апарату продуктами реакції або тепло, що міститься в продуктах в кінці теплової стадії, кДж;
- тепло, що виноситься з апарату продуктами реакції або тепло, що міститься в продуктах в кінці теплової стадії, кДж;
 - тепло, що витрачається на нагрівання (охолодження) окремих частин апарату, кДж;
- тепло, що витрачається на нагрівання (охолодження) окремих частин апарату, кДж;
|
|
|
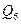 - тепло, що витрачається апаратом у навколишнє середовище, кДж.
- тепло, що витрачається апаратом у навколишнє середовище, кДж.
Рівняння справедливе як для процесів, що проходять при нагріванні, так і для процесів, що відбуваються при охолодженні. Але в останньому випадку 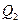 має від'ємне значення.
має від'ємне значення.
Основну величину 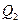 визначають з рівняння:
визначають з рівняння:
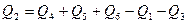 , кДж.
, кДж.
Кількість тепла, що вноситься в апарат з вихідними речовинами, або ж виноситься з апарату з продуктами реакції, може бути визначена за формулою:
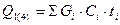 , кДж,
, кДж,
де 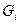 - маса і-того компоненту на одне операційне завантаження, кг;
- маса і-того компоненту на одне операційне завантаження, кг;
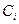 - питома теплоємність і-того компоненту, кДж/(кг·К);
- питома теплоємність і-того компоненту, кДж/(кг·К);
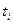 - температура і-того компоненту, °С.
- температура і-того компоненту, °С.
Величини 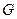 беруть із даних матеріального балансу (для апаратів періодичної дії - маса речовин на одне завантаження; для безперервних процесів - маса речовин, що переробляються за 1 годину роботи апарату). Значення температур беруть із регламенту, а теплоємності - з довідників.
беруть із даних матеріального балансу (для апаратів періодичної дії - маса речовин на одне завантаження; для безперервних процесів - маса речовин, що переробляються за 1 годину роботи апарату). Значення температур беруть із регламенту, а теплоємності - з довідників.
Якщо відсутні дані про теплоємність органічної речовини, то її можна визначити за правилом Коппа:
 ,
,
де 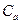 - атомна теплоємність елементів, що входять у склад молекули, кДж/(кг·К);
- атомна теплоємність елементів, що входять у склад молекули, кДж/(кг·К);
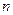 - число однойменних атомів у молекулі;
- число однойменних атомів у молекулі;
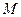 - молекулярна маса сполуки.
- молекулярна маса сполуки.
Величину теплоємності, розраховану за формулою Коппа, рекомендується збільшити на 5-10%.
Значення теплоємностей розчинів, сплавів, скла, можуть бути розраховані за адитивною схемою:

 - вміст сполук, що входять до складу вказаних розчинів і сумішей у масових %;
- вміст сполук, що входять до складу вказаних розчинів і сумішей у масових %;
 - теплоємності цих сполук, кДж/(кг·К).
- теплоємності цих сполук, кДж/(кг·К).
Таблиця 6.1
Атомні теплоємності елементів речовин у твердому ( )
)
або у рідкому стані (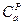 ), Дж/(моль·К)
), Дж/(моль·К)
| Елементи | 
| 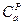
|
| Вуглець | 7,54 | 11,73 |
| Водень | 9,64 | 18,02 |
| Кисень | 16,76 | 25,14 |
| Сірка | 22,63 | 31,01 |
| Фосфор | 23,04 | 29,33 |
| Фтор | 20,95 | 29,33 |
| Кремній | 20,11 | 24,30 |
| Інші елементи | 25,98-26,82 | 33,52 |
Теплоємність газів і парів можна наближено розраховувати за їх молекулярним складом (кДж/(кг·К)).
Теплоємність при постійному об'ємі:
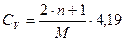 ,
,
де n – число атомів у молекулі сполуки;
|
|
|
М – молекулярна маса сполуки.
Теплоємність при постійному тиску:
 .
.
При технічних розрахунках практично можна користуватися даними, згідно з якими теплоємність більшості рідин знаходиться в межах 1,7-2,5 кДж/(кг·К).
Теплоємність більшості органічних сполук дорівнює 1,7-2,5 кДж/(кг·К). Виключенням є галогеновмісні сполуки, а також вода, аміак і деякі інші речовини.
При розрахунку 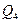 необхідно знати ступінь перетворення вихідних речовин у продукти реакції на даній тепловій підстадії. Це спричиняє необхідність проведення додаткових матеріальних розрахунків.
необхідно знати ступінь перетворення вихідних речовин у продукти реакції на даній тепловій підстадії. Це спричиняє необхідність проведення додаткових матеріальних розрахунків.
Якщо припустити, що на першій тепловій підстадії, ступінь перетворення складає 20%, то очевидно, що продукти реакції на цій стадії будуть представляти собою суміш, у якій міститься по 20% (від загальної кількості речовин, які утворюються з урахуванням коефіцієнту виходу на стадії) кінцевих продуктів реакції і по 80% вихідних продуктів, які вступають у хімічну взаємодію, плюс надлишок вихідних компонентів.
Якщо технологічний процес відбувається без відгонки компонентів і виділення газів, то тепло, яке міститься в продуктах реакції попередньої теплової стадії дорівнює теплу, яке вноситься в апарат з вихідними матеріалами наступної теплової стадії (тобто  ).
).
Якщо ж під час проведення процесу на попередній тепловій стадії проходить відгонка певних компонентів або виділення газів, то ці величини не рівні. В таких випадках доцільно кількість тепла, що міститься в продуктах, які відганяються, або виділяються на попередній тепловій стадії, розрахувати окремо (як 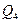 ), щоб зберегти вказану вище рівність.
), щоб зберегти вказану вище рівність.
Витрата тепла на нагрівання окремих частин апарату визначається за формулою:
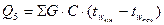 , кДж,
, кДж,
де 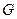 - маса окремих частин апарату, кг;
- маса окремих частин апарату, кг;
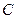 - теплоємність окремих частин апарату, кДж/(кг·К);
- теплоємність окремих частин апарату, кДж/(кг·К);
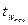 - середня початкова температура окремих частин апарату (стінки), °С, рівна температурі приміщенняцеху, тобто 20-25 °С;
- середня початкова температура окремих частин апарату (стінки), °С, рівна температурі приміщенняцеху, тобто 20-25 °С;
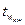 - середня кінцева температура окремих частин апарату (стінки), °С.
- середня кінцева температура окремих частин апарату (стінки), °С.

Рис. 6.2 До розрахунку  i
i 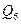 : 1-емалеве покриття; 2 – стінка апарату;
: 1-емалеве покриття; 2 – стінка апарату;
3 – стінка оболонки; 4 - теплоізоляції
Середня кінцева температура 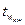 дорівнює середньому арифметичному між температурами стінок з боку гріючого теплоносія і реакційної маси:
дорівнює середньому арифметичному між температурами стінок з боку гріючого теплоносія і реакційної маси:
|
|
|
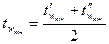 , оС,
, оС,
де 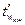 - температура стінки з боку більш нагрітого середовища, °С;
- температура стінки з боку більш нагрітого середовища, °С;
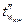 - температура стінки з боку менш нагрітого середовища, °С;
- температура стінки з боку менш нагрітого середовища, °С;
 , оС;
, оС;
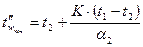 , оС;
, оС;
 ,
,
де 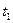 - температура теплоносія, °С;
- температура теплоносія, °С;
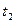 - температура реакційної маси, °С;
- температура реакційної маси, °С;
 - коефіцієнт тепловіддачі від теплоносія до стінки, Вт/(м2·К);
- коефіцієнт тепловіддачі від теплоносія до стінки, Вт/(м2·К);
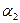 - коефіцієнт тепловіддачі від стінки до реакційної маси, Вт/(м2·К);
- коефіцієнт тепловіддачі від стінки до реакційної маси, Вт/(м2·К);
 - коефіцієнт теплопередачі від теплоносія до реакційної маси, Вт/(м2·К);
- коефіцієнт теплопередачі від теплоносія до реакційної маси, Вт/(м2·К);
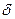 - товщина стінки апарату (одного шару стінки), м;
- товщина стінки апарату (одного шару стінки), м;
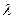 - теплопровідність стінки (одного шару стінки), Вт/(м2·К).
- теплопровідність стінки (одного шару стінки), Вт/(м2·К).
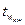 розраховується для кожної частини апарату.
розраховується для кожної частини апарату.
Тепло, що втрачається в навколишнє середовище:
 , кДж,
, кДж,
де  - поверхня частини апарату, що втрачає тепло (холод), м2;
- поверхня частини апарату, що втрачає тепло (холод), м2;
β – коефіцієнт тепловіддачі від стінки апарату в навколишнє середовище, Вт/(м2·К);
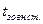 – температура зовнішньої поверхні стінок апарату, °С;
– температура зовнішньої поверхні стінок апарату, °С;
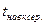 – температура навколишнього середовища, °С;
– температура навколишнього середовища, °С;
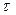 - тривалість процесу, год;
- тривалість процесу, год;
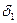 – товщина стінки оболонки, м;
– товщина стінки оболонки, м;
 – товщина теплоізоляції, м;
– товщина теплоізоляції, м;
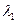 – теплопровідність матеріалу стінки оболонки, Вт/(м·К);
– теплопровідність матеріалу стінки оболонки, Вт/(м·К);
 – теплопровідність теплоізоляції, Вт/(м·К)
– теплопровідність теплоізоляції, Вт/(м·К)
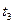 - температура стінки оболонки зі сторони теплоносія, °С;
- температура стінки оболонки зі сторони теплоносія, °С;
 - температура стінки оболонки зі сторони теплоізоляції, °С;
- температура стінки оболонки зі сторони теплоізоляції, °С;
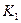 - коефіцієнт теплопередачі від теплоносія в навколишнє середовище через стінку оболонки і теплоізоляцію, Вт/(м2·К).
- коефіцієнт теплопередачі від теплоносія в навколишнє середовище через стінку оболонки і теплоізоляцію, Вт/(м2·К).
Коефіцієнт 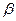 є алгебраїчною сумою тепловіддачі конвекцією
є алгебраїчною сумою тепловіддачі конвекцією 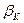 і випромінюванням
і випромінюванням 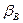 . Якщо температура стінок не перевищує 200 °С, то величиною
. Якщо температура стінок не перевищує 200 °С, то величиною 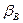 можна знехтувати. Величина
можна знехтувати. Величина 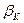 визначається за формулою:
визначається за формулою:
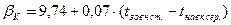 , Вт/(м2ּК)
, Вт/(м2ּК)
Згідно прийнятих позначень,
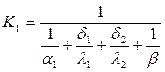 , Вт/(м2ּК);
, Вт/(м2ּК);
 , оС;
, оС;
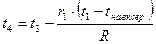 , оС;
, оС;
де 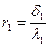 , а
, а 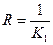 ;
;
 , оС.
, оС.
З наведених формул видно, що для розрахунку температури зовнішньої стінки теплоізоляції (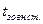 ) необхідно прийняти відповідну її товщину (
) необхідно прийняти відповідну її товщину ( ) і матеріал з певною теплопровідністю (
) і матеріал з певною теплопровідністю ( ).
).
З огляду максимального збереження енергії (у випадку застосування теплоносіїв) і вимог техніки безпеки температура 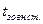 повинна бути в межах 30-40°С.
повинна бути в межах 30-40°С.
Тепловий ефект процесу 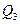 - це сумарна кількість тепла, яке виділяється або поглинається при перебігу хімічних реакцій і фізико-хімічних процесів, що їх супроводжують (розчинення, топлення, випаровування, гідратація тощо).
- це сумарна кількість тепла, яке виділяється або поглинається при перебігу хімічних реакцій і фізико-хімічних процесів, що їх супроводжують (розчинення, топлення, випаровування, гідратація тощо).
|
|
|
Величина теплового ефекту процесу визначається за формулою:
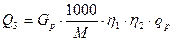 , кДж,
, кДж,
де  - маса 100%-ної реагуючої сполуки на одне завантаження, кг;
- маса 100%-ної реагуючої сполуки на одне завантаження, кг;
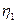 - коефіцієнт виходу хімічної реакції, соті долі відсотка;
- коефіцієнт виходу хімічної реакції, соті долі відсотка;
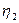 - коефіцієнт виходу хімічної реакції на тепловій підстадії, соті долі відсотка;
- коефіцієнт виходу хімічної реакції на тепловій підстадії, соті долі відсотка;
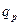 - молярний тепловий ефект хімічної реакції, кДж/(г·моль).
- молярний тепловий ефект хімічної реакції, кДж/(г·моль).
Відповідно до закону Гесса і його наслідків, можливі наступні методи розрахунку молярних теплових ефектів хімічних реакцій 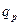 :
:
- щоб обчислити тепловий ефект хімічної реакції, використовуючи дані теплот утворення сполук, необхідно від суми теплот утворення продуктів реакції відняти суму теплот утворення вихідних речовин,
- щоб обчислити тепловий ефект хімічної реакції, користуючись теплотою згоряння сполук, необхідно від суми теплот згоряння вихідних речовин відняти суму теплот згоряння продуктів реакції.
- тепловий ефект хімічної реакції може бути також визначений за допомогою алгебраїчного комбінування рівнянь окремих реакцій з урахуванням їх теплових ефектів.
- тепловий ефект хімічної реакції може бути також визначений за константами рівноваги реакції.
- в окремих випадках для розрахунку теплових ефектів використовують дані про енергію зв'язків у молекулах реагуючих речовин. Під енергією зв'язку розуміють кількість енергії, яку необхідно витратити на розрив такого зв'язку.
Перший з названих вище методів розрахунку молярних теплових ефектів реакцій є основним. Відповідно до нього:
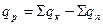 , кДж/моль,
, кДж/моль,
де 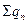 і
і 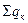 - сума теплот утворення сполук, що вступають в реакцію і утворюються в результаті реакції відповідно, кДж/моль.
- сума теплот утворення сполук, що вступають в реакцію і утворюються в результаті реакції відповідно, кДж/моль.
Теплоти утворення сполук можуть бути знайдені в довідниках фізико-хімічних величин. При відсутності цих даних, їх можна розрахувати за теплотами згоряння, як різницю між теплотою згоряння елементів, що входять до складу сполуки і теплотою згоряння самої сполуки:
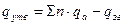 ,
,
де 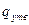 - теплота утворення сполуки, кДж/моль;
- теплота утворення сполуки, кДж/моль;
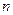 - число однойменних атомів у молекулі;
- число однойменних атомів у молекулі;
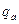 - теплота згоряння 1 грам-атома елемента, кДж;
- теплота згоряння 1 грам-атома елемента, кДж;
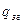 - теплота згоряння сполуки, кДж/моль.
- теплота згоряння сполуки, кДж/моль.
Теплоти згоряння 1 моля атомів деяких елементів 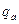 наводяться нижче:
наводяться нижче:
Таблиця 6.2
Мольні теплоти згоряння деяких елементів
| Елементи | 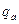 , кДж/моль атомів , кДж/моль атомів
|
| Вуглець | 395,45 |
| Водень | 143,25 |
| Хлор, бром, йод | 0 (22,08); 0 (23,07); 0 |
| Кисень | |
| Азот | 0 (65,4) |
| Сірка | 290,36 (582,83) |
| Фтор | 173,46 |
Переважно продуктами згоряння органічних сполук є газоподібні сполуки СО2, Cl2, N2, SО2, H2О, Br2, HF. Значення, наведені у дужках, відносяться до продуктів згоряння HBr, HCІ, HNО3, H2S04, які одержані у вигляді водних розчинів.
Теплоти згоряння 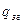 рідких органічних сполук можуть бути визначені за формулою Караша:
рідких органічних сполук можуть бути визначені за формулою Караша:
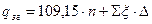 , кДж/моль,
, кДж/моль,
де 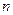 - число електронів, що переміщуються при згорянні органічної сполуки;
- число електронів, що переміщуються при згорянні органічної сполуки;
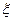 - число однойменних замісників;
- число однойменних замісників;
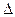 - теплова поправка на зв'язок із замісником, кДж/моль.
- теплова поправка на зв'язок із замісником, кДж/моль.
У тих випадках, коли необхідно визначити теплоту утворення сполук, що знаходяться в іншому агрегатному стані, враховують поправки на агрегатний стан, тобто вносять поправки на теплоти фізичних процесів: топлення і випаровування (пароутворення).
Враховуючи поправки на агрегатний стан теплота утворення сполуки буде дорівнювати:
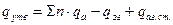 ,
,
де  - теплова поправка на агрегатний стан, кДж/кг.
- теплова поправка на агрегатний стан, кДж/кг.
Загальні формули теплових поправок на агрегатний стан наведені в таблиці 6.
Таблиця 6.3
Теплові поправки на агрегатний стан qаг
| Вихідні речовини | Для одержуваних продуктів | ||
| газ (пара) | рідина | тверда речовина | |
| Газ (пара) | - + + 
| + 
| + - - 
|
| Рідина | -
| +
| |
| Тверда речовина | + - - 
| -
| + - - 
|
Примітка:
 – теплота випаровування (пароутворення), кДж/кг;
– теплота випаровування (пароутворення), кДж/кг;
 – теплота топлення, кДж/кг.
– теплота топлення, кДж/кг.
Верхній індекс «0» відноситься до одежуваного продукту, верхній індекс «в» - до вихідної речовини.
Теплоти фізичних процесів розраховують наступним чином.
Теплота випаровування  (кДж/кг) може бути розрахована за формулами:
(кДж/кг) може бути розрахована за формулами:
Клаузіуса-Клапейрона:
 ;
;
Кистяківського:
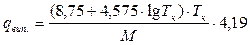 ;
;
Трутона:
 ;
;
за емпіричною формулою:
 ,
,
де  – тиск парів рідини при Т1 і Т2 оК відповідно, МПа;
– тиск парів рідини при Т1 і Т2 оК відповідно, МПа;
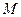 – молекулярна маса рідини, що випаровується;
– молекулярна маса рідини, що випаровується;
 – температура кипіння рідини, оК;
– температура кипіння рідини, оК;
 – постійна величина, що дорівнює 20-22;
– постійна величина, що дорівнює 20-22;
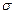 – сума валентностей атомів, що входять у склад сполуки.
– сума валентностей атомів, що входять у склад сполуки.
Останню формулу використовують для визначення  (кДж/кг) сполук, що розкладаються при температурі нижчій від температури кипіння (температура кипіння невідома).
(кДж/кг) сполук, що розкладаються при температурі нижчій від температури кипіння (температура кипіння невідома).
Теплота топлення  (кДж/кг) може бути визначена за формулою:
(кДж/кг) може бути визначена за формулою:
 ,
,
де  - постійна величина, яка дорівнює 2-3 для елементів, 5-7 для неорганічних сполук та 9-15 для органічних сполук;
- постійна величина, яка дорівнює 2-3 для елементів, 5-7 для неорганічних сполук та 9-15 для органічних сполук;
 - температура топлення, оК;
- температура топлення, оК;
Між температурою топлення  (оК) та температурою кипіння
(оК) та температурою кипіння  (оК) існує наступна залежність (правило Лоренца):
(оК) існує наступна залежність (правило Лоренца):

 ,
,
де  - постійна величина, яка дорівнює 0,58 для органічних сполук і 0,72 для неорганічних сполук.
- постійна величина, яка дорівнює 0,58 для органічних сполук і 0,72 для неорганічних сполук.
Відповідно, між теплотою випаровування 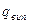 та теплотою топлення
та теплотою топлення  для органічних сполук існує така залежність (правило Трутона):
для органічних сполук існує така залежність (правило Трутона):
 або
або  .
.
Теплота розчинення твердих речових 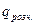 (кДж/кг) визначається за формулою:
(кДж/кг) визначається за формулою:
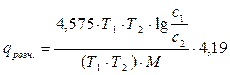 ,
,
де  - розчинність речовини при
- розчинність речовини при 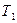 і
і  °К, відповідно.
°К, відповідно.
Значення теплот процесів змішування  , в яких приймають участь лише неорганічні сполуки (наприклад, кислота з водою, кислота з олеумом, луг з водою тощо) досить великі і потребують точних розрахунків. Методики цих розрахунків детально викладені у книзі Плановського А.Н., Гуревича Д.А. [17].
, в яких приймають участь лише неорганічні сполуки (наприклад, кислота з водою, кислота з олеумом, луг з водою тощо) досить великі і потребують точних розрахунків. Методики цих розрахунків детально викладені у книзі Плановського А.Н., Гуревича Д.А. [17].
Менший тепловий ефект спостерігається при змішуванні органічних речовин з неорганічними (наприклад, спирту з хлороводнем або водою). Теплоти змішування органічних речовин, як правило, невеликі і ними можна знехтувати.
Теплоти змішування багатьох сполук підбирають за табличними даними.
У довідниках переважно відсутні теплоти утворення солей органічних кислот, фенолів, амінів.
Їх розрахунок проводять за наступними рівняннями:
- теплота утворення солей органічних кислот:
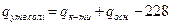 , кДж/моль;
, кДж/моль;
- теплота утворення фенолятів:
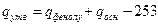 , кДж/моль;
, кДж/моль;
- теплота утворення солей амінів:
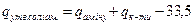 , кДж/моль.
, кДж/моль.
Величини теплот утворення  знаходять у довідниках або ж визначають шляхом розрахунку.
знаходять у довідниках або ж визначають шляхом розрахунку.
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 1622; Нарушение авторских прав?; Мы поможем в написании вашей работы!