
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения задач. Пример 1.Рассчитать стандартный электродный потенциал пары Cu2+/Cu+ по данным таблицы 11.1 для пар Cu2+/Cu и Cu+/Cu
|
|
|
|
Пример 1. Рассчитать стандартный электродный потенциал пары Cu2+/Cu+ по данным таблицы 11.1 для пар Cu2+/Cu и Cu+/Cu.
Решение.
Cu2+ + 2e = Cu 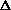 Go = - nFEo = -2(96485 Кл. моль-1)(+0.337 В) = -65031 Дж. моль-1.
Go = - nFEo = -2(96485 Кл. моль-1)(+0.337 В) = -65031 Дж. моль-1.
Cu+ + e = Cu 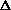 Go = - nFEo = -(96485 Кл. моль-1)(+0.521 В) = -50269 Дж. моль-1.
Go = - nFEo = -(96485 Кл. моль-1)(+0.521 В) = -50269 Дж. моль-1.
Вычитая, получаем:
Cu2+ + e = Cu+ 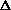 Go = - nFEo = -3(96485 Кл. моль-1) Eo = -14762 Дж. моль-1,
Go = - nFEo = -3(96485 Кл. моль-1) Eo = -14762 Дж. моль-1,
откуда Eo = +0.153 В.
Пример 2. Составить схему гальванического элемента, в котором протекает реакция
Ag+ + Br- = AgBr.
Рассчитать стандартную ЭДС элемента при 25o C, 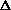 Go и константу равновесия реакции и растворимость AgBr в воде.
Go и константу равновесия реакции и растворимость AgBr в воде.
Решение. Ag | AgBr| Br- || Ag+ | Ag
Правый электрод: Ag+ + e = Ag Eo = 0.7792 В
Левый электрод: AgBr + e = Ag + Br- Eo = 0.0732 В
Общая реакция: Ag+ + Br- = AgBr Eo = 0.7260 В
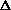 Go = - nFEo = -(96485 Кл.моль-1)(0.7260 В) = -70.05 кДж. моль-1
Go = - nFEo = -(96485 Кл.моль-1)(0.7260 В) = -70.05 кДж. моль-1
 = 1.872. 1012
= 1.872. 1012
1/ K = a (Ag+). a (Br-) = m (Ag+). m (Br-). (
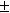 )2 = m 2 (
)2 = m 2 (
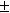 )2
)2
Отсюда, полагая 
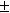 = 1, получаем m = 7.31. 10-7 моль. кг-1
= 1, получаем m = 7.31. 10-7 моль. кг-1
Пример 3. 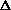 H реакции Pb + Hg2Cl2 = PbCl2 + 2Hg, протекающей в гальваническом элементе, равно -94.2 кДж. моль-1 при 298.2 K. ЭДС этого элемента возрастает на 1.45. 10-4 В при повышении температуры на 1К. Рассчитать ЭДС элемента и
H реакции Pb + Hg2Cl2 = PbCl2 + 2Hg, протекающей в гальваническом элементе, равно -94.2 кДж. моль-1 при 298.2 K. ЭДС этого элемента возрастает на 1.45. 10-4 В при повышении температуры на 1К. Рассчитать ЭДС элемента и 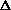 S при 298.2 K.
S при 298.2 K.
Решение.
 = 2. 96485. 1.45. 10-4 = 28.0 (Дж. моль-1. K-1).
= 2. 96485. 1.45. 10-4 = 28.0 (Дж. моль-1. K-1).
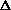 G =
G = 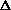 H - T
H - T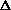 S = - nFE, откуда
S = - nFE, откуда
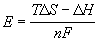 =
= 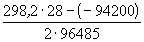 = 0.314 (В).
= 0.314 (В).
Ответ. 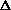 S = 28. Дж. моль-1 K-1; E = 0.314 В.
S = 28. Дж. моль-1 K-1; E = 0.314 В.
|
|
|
|
|
Дата добавления: 2014-10-23; Просмотров: 3339; Нарушение авторских прав?; Мы поможем в написании вашей работы!