
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическое выветривание
|
|
|
|
При химическом выветривании разрушение горных пород происходит с изменением их химического состава главным образом под воздействием кислорода, углекислого газа и воды, а также активных органических веществ содержащихся в атмосфере и гидросфере.
Главными реакциями, обуславливающими химическое выветривание, являются окисление, гидратация, растворение и гидролиз.
Окисление – это переход элементов с низкой валентностью в высоковалентное за счет присоединения кислорода. Особенно быстро окислению подвергаются сульфиды, некоторые слюды и другие темноцветные минералы.
Лимонит – это самая устойчивая форма существования железа в поверхностных условиях. Все ржавые пленки и ржаво-бурая окраска пород обусловлена присутствием гидроокислов железа. Так как железо постоянно входит в химический состав многих породообразующих минералов – значит при химическом выветривании этих минералов Fe++ перейдет в Fe+++, т.е. лимонит. Окисляется не только Fe, но и другие металлы.
В условиях недостатка кислорода протекает процесс восстановления, при котором металлы с высокой валентностью переходят в соединения с более низкой валентностью. Подобный процесс наиболее ярко протекает в зонах окисления сульфидных месторождений.
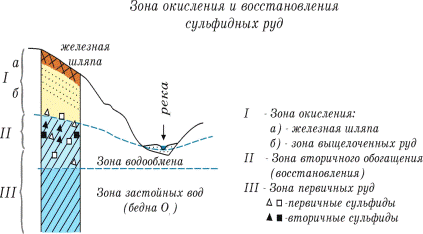
Рис. 2. Зона окисления и восстановления сульфидных руд
Выше уровня (зеркало) грунтовых вод располагается зона обогащения O2, и в ней интенсивно протекают процессы окисления, в результате чего сульфиды металлов переходят в сульфаты, которые хорошо растворимы и просачивающимися водами перемещаются вниз до уровня грунтовых вод в зону обедненную кислородом. В этой зоне сульфаты восстанавливаются и переходят во вторичные сульфиды в результате чего возникает зона богатых руд (зона вторичного обогащения). На поверхности же рудного тела в результате окисления и выщелачивания образуется так называемая железная шляпа, которая представляет собой каркас кварца пропитанного лимонитом. Процессы окисления и восстановления можно представить в виде схемы:
| Первичные Сульфиды Ме | окисление | Сульфаты | восстановление | Вторичные сульфиды Ме |
Гидратация – это химическое присоединение воды к минералам горных пород с образованием новых минералов (гидросиликатов и гидроокислов) с другими свойствами.
Fe2O3 + nH2O ® Fe2O3 ´ nH2O
гематит лимонит
CaSO4 + 2H2O ® CaSO4 ´ 2H2O
ангидрит гипс
превращение ангидрита в гипс всегда сопровождается значительным увеличением объема породы, что приводит к механическому разрушению всей гипс-ангидритовой толщи.
Растворение – способность молекул одного вещества распространяться вследствие диффузии в другом веществе. Оно происходит с различной скоростью для разных пород и минералов. Наибольшей растворимостью обладают хлориды (галит NaCl, сильвин KCl и др.). Менее растворимы сульфаты, карбонаты.
Гидролиз – наиболее важный процесс химического выветривания, т.к. путем гидролиза разрушаются силикаты и алюмосиликаты, которые слагают половину объема внешней части континентальной коры.
Гидролиз – это обменное разложение вещества под влиянием гидролитической диссоциации воды, сопровождающееся разрушением одних и образованием других минералов. Наиболее характерен пример гидролиза полевых шпатов:
K[AlSi3O8] + nH2O + CO2 ® K2CO3 + Al4[Si4O10](OH)8 + SiO2 ´ nH2O
ортоклаз в раствор каолинит опал
Дальнейший гидролиз каолинита приводит к его разложению и образованию латерита:
Al4[Si4O10](OH)8 ® H2Al2O4 + SiO2 ´nH2O Латерит
Интенсивность процесса гидролиза, которому сопутствуют растворение и гидратация, зависит от климатических условий: - в умеренном климате гидролиз протекает до стадии образования гидрослюд; - во влажном теплом климате – до стадии образования каолинита; - в субтропическом климате – до стадии образования латерита. Таким образом при гидролизе разрушаются силикаты, алюмосиликаты; на их месте накапливаются глинистые минералы, а за счет вытеснения катионов образуются свободные окислы и гидроокислы алюминия, железа, кремния, марганца.
Латериты являются ценными рудами на алюминий. При перемыве латеритной коры выветривания и переотложении гидроокислов алюминия формируются месторождения бокситов.
Стадии химического выветривания
В соответствии с приведенной последовательностью выделяются 4 стадии химического выветривания;
1. Обломочная, при которой породы превращаются в рыхлые продукты физического выветривания;
2. Обизвесткованного элювия (сиаллитная), когда начинается разложение силикатов, сопровождаемое удалением хлора, серы и обогащение пород карбонатами;
3. Глин (кислая сиаллитная стадия), когда продолжается разложение силикатов и происходит отщепление и вынос оснований (Ca, Mg, Na,K), а также образование каолиновых глин на кислых
породах и нонтронитовых – на основных;
4. Латеритов (аллитная), завершающая стадия химического выветривание, на которой идет дальнейшее разложение минералов (отщепляются и выносятся окислы и гидроокислы алюминия и
железа – гетит, гидрогетит и гиббсит, гидраргиллит).
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 887; Нарушение авторских прав?; Мы поможем в написании вашей работы!