
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 3. Вычислите величину электродного потенциала кобальта в 0,001-молярном растворе его соли
|
|
|
|
Пример 2.
Вычислите величину электродного потенциала кобальта в 0,001-молярном растворе его соли.
Решение.
Значение электродного потенциала металла зависит от многих факторов – природы металла, температуры, концентрации соли и т. д. Эта зависимость выражается уравнением Нернста:
EMen+/ Me = E0Men+/ Me +  lg [Men+ ´ mH2O],
lg [Men+ ´ mH2O],
где EMen+/ Me – электродный потенциал металла; E0Men+/ Me – стандартный электродный потенциал металла; n - заряд иона металла в соли; [Men+ ´ mH2O] – активная концентрация ионов металла в растворе.
Рассчитаем значение электродного потенциала кобальта в 0,001-молярном растворе его соли. Величину стандартного электродного потенциала кобальта выписываем из ряда напряжений [I]:
ECo2+/ Co = E0Co2+/ Co +  lg [Co2+ ´ mH2O],
lg [Co2+ ´ mH2O],
ECo2+/ Co = – 0,27 + 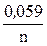 lg 0,001,
lg 0,001,
ECo2+/ Co = – 0,27 + 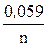 (–3),
(–3),
ECo2+/ Co = – 0,27 - 0,088,
ECo2+/ Co = – 0,358 В.
Составьте схемы двух гальванических элементов, в одном из которых кадмий будет анодом, в другом – катодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на электродах, и посчитайте электродвижущую силу (эдс) элементов.
Решение.
Устройства, используемые для преобразования энергии химической реакции в электрическую, называются гальваническими элементами. Элемент работает за счет протекания окислительно-восстановительной реакции. Электрод, на котором идет восстановление, называется катодом, а окисление протекает на аноде. Если анод и катод изготовлены из разных металлов, то на электроде из более активного металла (с меньшим значением электродного потенциала) идет процесс окисления и он играет роль анода. Менее активный металл будет катодом и на нем протекает процесс восстановления.
Электродвижущая сила гальванического элемента равна разности значений электродных потенциалов катода и анода: ЭДС = EК - EА.
Чтобы в гальваническом элементе кадмий был катодом (E0Cd = – 0,40 В), в качестве анода нужно подобрать электрод из более активного металла, например, марганца (E0Mn = – 1,18 В).
Схема гальванического элемента:
(-)Mn / Mn2+ // Cd2+ / Cd(+).
Уравнения реакций, протекающих на электродах:
на аноде (-) Mn0 – 2 = Mn2+ – окисление,
= Mn2+ – окисление,
на катоде (+) Cd2+ + 2 = Cd0 – восстановление,
= Cd0 – восстановление,
Mn0 + Cd2+ = Mn2+ + Cd0.
Рассчитаем ЭДС элемента по формуле
ЭДС = EК - EА = ECd - EMn = – 0,40 - (– 1,18) = 0,78 В.
Если в пару с кадмием в качестве другого электрода взять менее активный металл, например, свинец (E0Pb = – 0,13 В), то кадмий будет играть роль анода.
Схема гальванического элемента:
(-)Cd / Cd2+ // Pb2+ / Pb(+).
Уравнения реакций протекающих на электродах:
на аноде (-) Cd0 – 2 = Cd2+ – окисление,
= Cd2+ – окисление,
на катоде (+) Pb2+ + 2 = Pb0 – восстановление.
= Pb0 – восстановление.
Рассчитаем ЭДС элемента по формуле
ЭДС = EК - EА = EPb - ECd = - 0,13 - (- 0,40) = 0,27 В.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 1833; Нарушение авторских прав?; Мы поможем в написании вашей работы!