
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
КУРС ФИЗИКИ 41 страница
|
|
|
|
Д. И. Менделеев ввел понятие порядкового номера Z химического элемента, равного числу протонов в ядре и соответственно общему числу электронов в электронной оболочке атома. Расположив химические элементы по мере возрастания порядковых номеров, он получил периодичность в изменении химических свойств элементов. Однако для известных в то время 64 химических элементов некоторые клетки таблицы оказались незаполненными, так как соответствующие им элементы (например, Ga, Se, Ос) тогда еще не были известны. Д. И. Менделеев, таким образом, не только правильно расположил известные элементы, но и предсказал существование новых, еще не открытых элементов и их основные свойства. Кроме того, Д. И. Менделееву удалось уточнить атомные веса некоторых элементов. Например, атомные веса Be и U, вычисленные на основе таблицы Менделеева, оказались правильными, а полученные ранее экспериментально — ошибочными.
Так как химические и некоторые физические свойства элементов объясняются внешними (валентными) электронами в атомах, то периодичность свойств химических элементов должна быть связана с определенной периодичностью в расположении электронов в атомах. Поэтому для объяснения таблицы будем считать, что каждый последующий элемент образован из предыдущего прибавлением к ядру одного протона и соответственно прибавлением одного электрона в электронной оболочке атома. Взаимодействием электронов пренебрегаем, внося, где это необходимо, соответствующие поправки. Рассмотрим атомы химических элементов, находящиеся в основном состоянии.
Единственный электрон атома водорода находится в состоянии 1 s, характеризуемом квантовыми числами п= 1, l= 0, ml =0 и ms =± ½; (ориентация его спина произвольна). Оба электрона атома Не находятся в состоянии 1 s, но с антипараллельной ориентацией спина. Электронная конфигурация для атома Не записывается как 1 s 2(два 1 s -электрона). На атоме Не заканчивается заполнение K -оболочки, что соответствует завершению I периода Периодической системы элементов Менделеева (табл. 7).
Таблица 7
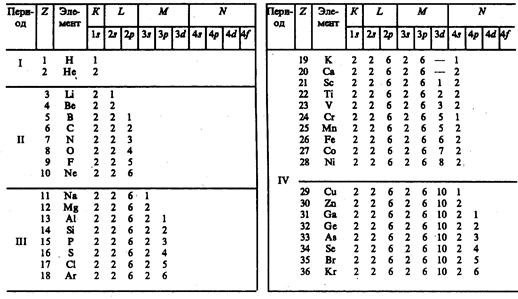
Третий электрон атома Li (Z =3), согласно принципу Паули, уже не может разместиться в целиком заполненной K -оболочке и занимает наинизшее энергетическое состояние с n =2 (L -оболочка), т.е. 2 s -состояние. Электронная конфигурация для атома Li: 1 s 22 s. Атомом Li начинается II период Периодической системы элементов. Четвертым электроном Be (Z =4) заканчивается заполнение подоболочки 2 s. У следующих шести элементов от В (Z= 5 ) до Ne (Z= 10) идет заполнение подоболочки 2 р (табл. 7). II период Периодической системы заканчивается неоном — инертным газом, для которого подоболочка 2 р целиком заполнена.
Одиннадцатый электрон Na (Z =11) размещается в М -оболочке (n =3), занимая наинизшее состояние 3 s. Электронная конфигурация имеет вид 1 s 22 s 22 p 63 s. 3 s -Электрон (как и 2 s -электрон Li) является валентным электроном, поэтому оптические свойства Na подобны свойствам Li. С Z= 12 идет последовательное заполнение M -оболочки. Аr (Z =18) оказывается подобным Не и Ne: в его наружной оболочке все s- и p -состояния заполнены. Аr является химически инертным и завершает III период Периодической системы.
Девятнадцатый электрон К (Z =19) должен был бы занять 3 d -состоянис в M -оболочке. Однако и в оптическом, и в химическом отношениях атом К схож с атомами Li и Na, которые имеют внешний валентный электрон в s -состоянии. Поэтому 19-й валентный электрон К должен также находиться в s -состоянии, но это может быть только s -состояние новой оболочки (N -оболочки), т. е. заполнение N -оболочки для К начинается при незаполненной M -оболочке. Это означает, что в результате взаимодействия электронов состояние n =4, l =0 имеет меньшую энергию, чем состояние n =3, l= 2. Спектроскопические и химические свойства Са (Z =20) показывают, что его 20-й электрон также находится в 4 s -состоянии N -оболочки. В последующих элементах происходит заполнение M -оболочки (от Sc (Z= 21) до Zn (Z =30)). Далее N -оболочка заполняется до Кr (Z =36), у которого опять-таки, как и в случае Ne и Аr,
s- и p -состояния наружной оболочки заполнены целиком. Криптоном заканчивается IV период Периодической системы. Подобные рассуждения применимы и к остальным элементам таблицы Менделеева, однако эти данные можно найти в справочниках. Отметим лишь, что и начальные элементы последующих периодов Rb, Cs, Fr являются щелочными металлами, а их последний электрон находится в s -состоянии. Кроме того, атомы инертных газов (Не, Ne, Ar, Кr, Хе, Rn) занимают в таблице особое положение — в каждом из них s - и p- состояния наружной оболочки целиком заполнены и ими завершаются очередные периоды Периодической системы.
Каждую из двух групп элементов — лантаниды (от лантана (Z =57) до лютеция (Z =71)) и актиниды (от актиния (Z =89) до лоуренсия (Z =103)) — приходится помещать в одну клетку таблицы, таккак химические свойства элементов в пределах этих групп очень близки. Это объясняется тем, что для лантанидов заполнение подоболочки 4 f, которая может содержать 14 электронов, начинается лишь после того, как целиком заполнятся подоболочки 5 s, 5 p и 6 s. Поэтому для этих элементов внешняя P -оболочка (6 s 2) оказывается одинаковой. Аналогично, одинаковой для актинидов является Q -оболочка (7 s 2).
Таким образом, открытая Менделеевым периодичность в химических свойствах элементов объясняется повторяемостью в структуре внешних оболочек у атомов родственных элементов. Так, инертные газы имеют одинаковые внешние оболочки из 8 электронов (заполненные s- и p -состояния); во внешней оболочке щелочных металлов (Li, Na, К, Rb, Cs, Fr) имеется лишь один s -электрон; во внешней оболочке щелочноземельных металлов (Be, Mg, Ca, Sr, Ba, Ra) имеется два s -электрона; галоиды (F, О, Br, I, At) имеют внешние оболочки, в которых недостает одного электрона до оболочки инертного газа, и т. д.

§ 229. Рентгеновские спектры
Большую роль в выяснении строения атома, а именно распределения электронов по оболочкам, сыграло излучение, открытое в 1895 г. немецким физиком В. Рентгеном (1845—1923) и названное рентгеновским. Самым распространенным источником рентгеновского излучения является рентгеновская трубка, в которой сильно ускоренные электрическим полем электроны бомбардируют анод (металлическая мишень из тяжелых металлов, например W или Pt), испытывая на нем резкое торможение. При этом возникает рентгеновское излучение, представляющее собой электромагнитные волны с длиной волны примерно 10–12—10–8 м. Волновая природа рентгеновского излучения доказана опытами по его дифракции, рассмотренными в § 182.
Исследование спектрального состава рентгеновского излучения показывает, что его спектр имеет сложную структуру (рис. 306) и зависит как от энергии электронов, так и от материала анода. Спектр представляет собой наложение сплошного спектра, ограниченного со стороны коротких длин волн некоторой границей lmin, называемой границей сплошного спектра, и линейчатого спектра — совокупности отдельных линий, появляющихся на фоне сплошного спектра.
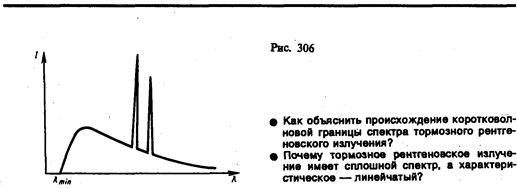
Исследования показали, что характер сплошного спектра совершенно не зависит от материала анода, а определяется только энергией бомбардирующих анод электронов. Детальное исследование свойств этого излучения показало, что оно испускается бомбардирующими анод электронами в результате их торможения при взаимодействии с атомами мишени. Сплошной рентгеновский спектр поэтому называют тормозным спектром. Этот вывод находится в согласии с классической теорией излучения, так как при торможении движущихся зарядов должно действительно возникать излучение со сплошным спектром.
Из классической теории, однако, не вытекает существование коротковолновой границы сплошного спектра. Из опытов следует, чточем больше кинетическая энергия электронов, вызывающих тормозное рентгеновское излучение, тем меньше lmin. Это обстоятельство, а также наличие самой границы объясняются квантовой теорией. Очевидно, что предельная энергия кванта соответствует такому случаю торможения, при котором вся кинетическая энергия электрона переходит в энергию кванта, т. е.
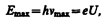
где U— разность потенциалов, за счет которой электрону сообщается энергия Е max, n max — частота, соответствующая границе сплошного спектра. Отсюда граничная длина волны
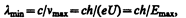 (229.1)
(229.1)
что полностью соответствует экспериментальным данным. Измеряя границу рентгеновского сплошного спектра, по формуле (229.1) можно определить экспериментальное значение постоянной Планка h, которое наиболее точно совпадает с современными данными.
При достаточно большой энергии бомбардирующих анод электронов на фоне сплошного спектра появляются отдельные резкие линии — линейчатый спектр, определяемый материалом анода и называемый характеристическим рентгеновским спектром (излучением).
По сравнению с оптическими спектрами характеристические рентгеновские спектры элементов совершенно однотипны и состоят из нескольких серий, обозначаемых К, L, М, и O. Каждая серия, в свою очередь, содержит небольшой набор отдельных линий, обозначаемых в порядке убывания длины волны индексами a, b, g,... (Кa, Кb, Кg,.... La, Lb, Lg,...). При переходе от легких элементов к тяжелым структура характеристического спектра не изменяется, лишь весь спектр смещается в сторону коротких волн. Особенность этих спектров заключается в том, что атомы каждого химического элемента, независимо от того, находятся ли они в свободном состоянии или входят в химическое соединение, обладают определенным, присущим только данному элементу линейчатым спектром характеристического излучения. Так, если анод состоит из нескольких элементов, то и характеристическое рентгеновское излучение представляет собой наложение спектров этих элементов.
Рассмотрение структуры и особенностей характеристических рентгеновских спектров приводит к выводу, что их возникновение связано с процессами, происходящими во внутренних, застроенных электронных оболочках атомов, которые имеют сходное строение.
Разберем механизм возникновения рентгеновских серий, который схематически показан на рис. 307. Предположим, что под влиянием внешнего электрона или высокоэнергетического фотона вырывается один из двух электронов K -оболочки атома. Тогда на его место может перейти электрон с более удаленных от ядра оболочек L, M, N,.... Такие переходы сопровождаются испусканием рентгеновских квантов и возникновением спектральных линий К- серии: Кa (L ® K), Kb (M ® K), Kg (N ® K) и т. д. Самой длинноволновой линией К- серии является линия Ka. Частоты линий возрастают в ряду Ka ® Kb ® Kg, поскольку энергия, высвобождаемая при переходе электрона на K -оболочку с более удаленных оболочек, увеличивается. Наоборот, интенсивности линий в ряду Ka ® Kb ® Kg убывают, так как вероятность переходов электронов с L -оболочки на K -оболочку больше,чем с более удаленных оболочек М и N. К- серия сопровождается обязательно другими сериями, так как при испускании ее линий появляются вакансии в оболочках L, M,..., которые будут заполняться электронами, находящимися на более высоких уровнях.
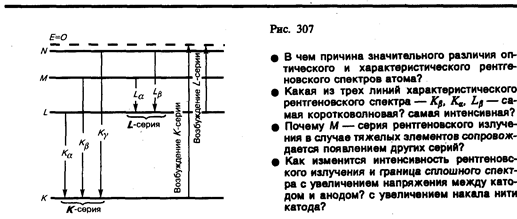
Аналогично возникают и другие серии, наблюдаемые, впрочем, только для тяжелых элементов. Рассмотренные линии характеристического излучения могут иметь тонкую структуру, поскольку уровни, определяемые главным квантовым числом, расщепляются согласно значениям орбитального и магнитного квантовых чисел.
Исследуя рентгеновские спектры элементов, английский физик Г. Мозли (1887—1915) установил в 1913 г. соотношение, называемое законом Мозли:
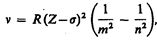 (229.2)
(229.2)
где n — частота, соответствующая данной линии характеристического рентгеновского излучения, R — постоянная Ридберга, s — постоянная экранирования, т = 1, 2, 3,... (определяет рентгеновскую серию), n принимает целочисленные значения начиная с m +1 (определяет отдельную линию соответствующей серии). Закон Мозли (229.2) подобен обобщенной формуле Бальмера (209.3) для атома водорода.
Смысл постоянной экранирования заключается в том, что на электрон, совершающий переход, соответствующий некоторой линии, действует не весь заряд ядра Zе,а заряд (Z – s) e, ослабленный экранирующим действием других электронов. Например, для Ka -линии s = 1, и закон Мозли запишется в виде
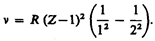
§ 230. Молекулы: химические связи, понятие об энергетических уровнях
Молекула — наименьшая частица вещества, состоящая из одинаковых или различных атомов, соединенных между собой химическими связями, и являющаяся носителем его основных химических и физических свойств. Химические связи обусловлены взаимодействием внешних, валентных электронов атомов. Наиболее часто в молекулах встречается два типа связи: ионная и ковалентная (см. § 71).
Ионная связь (например, в молекулах NaCl, KBr) осуществляется электростатическим взаимодействием атомов при переходе электрона одного атома к другому, т. е. при образовании положительного и отрицательного ионов. Ковалентная связь (например, в молекулах H2, С2, СО) осуществляется при обобществлении валентных электронов двумя соседними атомами (спины валентных электронов должны быть антипараллельны). Ковалентная связь объясняется на основе принципа неразличимости тождественных частиц (см. § 226), например электронов в молекуле водорода. Неразличимость частиц приводит к специфическому взаимодействию между ними, называемому обменным взаимодействием. Это чисто квантовый эффект, не имеющий классического объяснения, но его можно себе представить так, что электрон каждого из атомов молекулы водорода проводит некоторое время у ядра другого атома и, следовательно, осуществляется связь обоих атомов, образующих молекулу. При сближении двух водородных атомов до расстояний порядка боровского радиуса возникает их взаимное притяжение и образуется устойчивая молекула водорода.
Молекула является квантовой системой; она описывается уравнением Шредингера, учитывающим движение электронов в молекуле, колебания атомов молекулы, вращение молекулы. Решение этого уравнения — очень сложная задача, которая обычно разбивается на две: для электронов и ядер.
Энергия изолированной молекулы
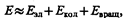 (230.1)
(230.1)
где Е эл — энергия движения электронов относительно ядер, Е кол — энергия колебаний ядер (в результате которых периодически изменяется относительное положение ядер), Е вращ — энергия вращения ядер (в результате которых периодически изменяется ориентация молекулы в пространстве). В формуле (230.1) не учтены энергия поступательного движения центра масс молекулы и энергия ядер атомов в молекуле. Первая из них не квантуется, поэтому ее изменения не могут привести к возникновению молекулярного спектра, а вторую можно не учитывать, если не рассматривать сверхтонкую структуру спектральных линий. Отношения Е эл: Е кол: Е вращ = 1: 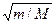 : т/М, где т — масса электрона, М — величина, имеющая порядок массы ядер атомов в молекуле, т/М»10–5¸10–3. Поэтому Е эл >> Е кол >> Е вращ. Доказано, что Е эл»1¸10 эВ, Е кол»10–2¸10–1 эВ, Е вращ»10–5¸10–3эВ.
: т/М, где т — масса электрона, М — величина, имеющая порядок массы ядер атомов в молекуле, т/М»10–5¸10–3. Поэтому Е эл >> Е кол >> Е вращ. Доказано, что Е эл»1¸10 эВ, Е кол»10–2¸10–1 эВ, Е вращ»10–5¸10–3эВ.
Каждая из входящих в выражение (230.1) энергий квантуется (ей соответствует набор дискретных уровней энергии) и определяется квантовыми числами. При переходе из одного энергетического состояния в другое поглощается или испускается энергия D E = hn. При таких переходах одновременно изменяются энергия движения электронов, энергии колебаний н вращения. Из теории и эксперимента следует, что расстояние между вращательными уровнями энергии D E вращ гораздо меньше расстояния между колебательными уровнями D E кол которое, в свою очередь, меньше расстояния между электронными уровнями D E эл. На рис. 308 схематически представлены уровни энергии двухатомной молекулы (для примера рассмотрены только два электронных уровня — показаны жирными линиями).
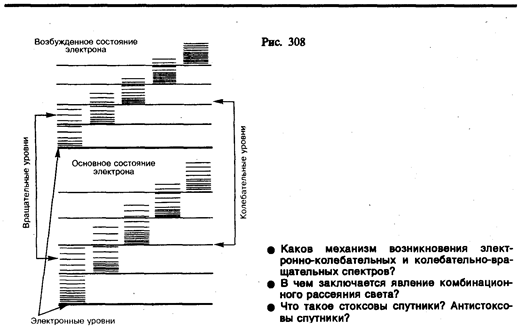
Как будет показано в § 231, структура энергетических уровней молекул определяет их спектр излучения, возникающий при квантовых переходах между соответствующими энергетическими уровнями.
§ 231. Молекулярные спектры. Комбинационное рассеяние света
Строение молекул и свойства их энергетических уровней проявляются в молекулярных спектрах — спектрах излучения (поглощения), возникающих при квантовых переходах между уровнями энергии молекул. Спектр излучения молекулы определяется структурой ее энергетических уровней и соответствующими правилами отбора (так, например, изменение квантовых чисел, соответствующих как колебательному, так и вращательному движению, должно быть равно ± 1).
Итак, при разных типах переходов между уровнями возникают различные типы молекулярных спектров. Частоты спектральных линий, испускаемых молекулами, могут соответствовать переходам с одного электронного уровня на другой (электронные спектры) или с одного колебательного (вращательного) уровня на другой (колебательные (вращательные) спектры). Кроме того, возможны и переходы с одними значениями D E кол и D E вращ на уровни, имеющие другие значения всех трех компонентов, в результате чего возникают электронно-колебательные и колебательно-вращательные спектры. Поэтому спектр молекул довольно сложный.
Типичные молекулярные спектры — полосатые, представляющие собой совокупность более или менее узких полос в ультрафиолетовой, видимой и инфракрасной областях. Применяя спектральные приборы высокой разрешающей способности, можно видеть, что полосы представляют собой настолько тесно расположенные линии, что они с трудом разрешаются. Структура молекулярных спектров различна для разных молекул и с увеличением числа атомов в молекуле усложняется (наблюдаются лишь сплошные широкие полосы). Колебательными и вращательными спектрами обладают только многоатомные молекулы, а двухатомные их не имеют. Это объясняется тем, что двухатомные молекулы не имеют дипольных моментов (при колебательных и вращательных переходах отсутствует изменение дипольного момента, что является необходимым условием отличия от нуля вероятности перехода).
В 1928 г. академики Г. С. Ландсберг (1890—1957) и Л. И. Мандельштам и одновременно индийские физики Ч. Раман (1888—1970) и К. Кришнан (р. 1911) открыли явление комбинационного рассеяния света. Если на вещество (газ, жидкость, прозрачный кристалл) падает строго монохроматический свет, то в спектре рассеянного света помимо несмещенной спектральной линии обнаруживаются новые линии, частоты которых представляют собой суммы или разности частоты n падающего света и частот ni собственных колебаний (или вращений) молекул рассеивающей среды.
Линии в спектре комбинационного рассеяния с частотами n – ni, меньшими частоты n падающего света, называются стоксовыми (или красными) спутниками, линии с частотами n + ni, большими n, — антистоксовыми (или фиолетовыми) спутниками. Анализ спектров комбинационного рассеяния приводит к следующим выводам: 1) линии спутников располагаются симметрично по обе стороны от несмещенной линии; 2) частоты ni не зависят от частоты падающего на вещество света, а определяются только рассеивающим веществом, т. е. характеризуют его состав и структуру; 3) число спутников определяется рассеивающим веществом; 4) интенсивность антистоксовых спутников меньше интенсивности стоксовых и с повышением температуры рассеивающего вещества увеличивается, в то время как интенсивность стоксовых спутников практически от температуры не зависит.
Объяснение закономерностей комбинационного рассеяния света дает квантовая теория. Согласно этой теории, рассеяние света есть процесс, в котором один фотон поглощается и один фотон испускается молекулой. Если энергии фотонов одинаковы, то в рассеянном свете наблюдается несмещенная линия. Однако возможны процессы рассеяния, при которых энергии поглощенного и испущенного фотонов различны. Различие энергии фотонов связано с переходом молекулы из нормального состояния в возбужденное (испущенный фотон будет иметь меньшую частоту — возникает стоксов спутник) либо из возбужденного состояния в нормальное (испущенный фотон будет иметь большую частоту — возникает антистоксов спутник).
Рассеяние света сопровождается переходами молекулы между различными колебательными или вращательными уровнями, в результате чего и возникает ряд симметрично расположенных спутников. Число спутников, таким образом, определяется энергетическим спектром молекул, т. е. зависит только от природы рассеивающего вещества. Так как число возбужденных молекул гораздо меньше, чем число невозбужденных, то интенсивность антистоксовых спутников меньше, чем стоксовых. С повышением температуры число возбужденных молекул растет, в результате чего возрастает и интенсивность антистоксовых спутников.
Молекулярные спектры (в том числе и спектры комбинационного рассеяния света) применяются для исследования строения и свойств молекул, используются в молекулярном спектральном анализе, лазерной спектроскопии, квантовой электронике и т. д.
§ 232. Поглощение. Спонтанное и вынужденное излучения
Как отмечалось выше, атомы могут находиться лишь в квантовых состояниях с дискретными значениями энергии Е 1, Е 2, Е 3 ,... Ради простоты рассмотрим только два из этих состояний (1 и 2) с энергиями Е 1 и Е 2. Если атом находится в основном состоянии 1, то под действием внешнего излучения может осуществиться вынужденный переход в возбужденное состояние 2 (рис. 309, а), приводящий к поглощению излучения. Вероятность подобных переходов пропорциональна плотности излучения, вызывающего эти переходы.
Атом, находясь в возбужденном состоянии 2, может через некоторый промежуток времени спонтанно, без каких-либо внешних воздействий, перейти в состояние с низшей энергией (в нашем случае в основное), отдавая избыточную энергию в виде электромагнитного излучения (испуская фотон с энергией hn=E 2 –Е 1). Процесс испускания фотона возбужденным атомом (возбужденной микросистемой) без каких-либо внешних воздействий называется спонтанным (или самопроизвольным) излучением (рис. 309, б). Чем больше вероятность спонтанных переходов, тем меньше среднее время жизни атома в возбужденном состоянии. Так как спонтанные переходы взаимно не связаны, то спонтанное излучение некогерентно.
В 1916 г. А. Эйнштейн для объяснения наблюдавшегося на опыте термодинамического равновесия между веществом и испускаемым и поглощаемым им излучением постулировал, что помимо поглощения и спонтанного излучения должен существовать третий, качественно иной тип взаимодействия. Если на атом, находящийся в возбужденном состоянии 2, действует внешнее излучение с частотой, удовлетворяющей условию hv=E 2 –E 1, то возникает вынужденный (индуцированный) переход в основное состояние 1 с излучением фотона той же энергии hv=E 2 –E 1 (рис. 309, в). При подобном переходе происходит излучение атомом фотона, дополнительно к тому фотону, под действием которого произошел переход. Возникающее в результате таких переходов излучение называется вынужденным (индуцированным) излучением. Таким образом, в процесс вынужденного излучения вовлечены два фотона: первичный фотон, вызывающий испускание излучения возбужденным атомом, и вторичный фотон, испущенный атомом. Существенно, что вторичные фотоны неотличимы от первичных, являясь точной их копией.

В статистической физике известен принцип детального равновесия, согласно которому при термодинамическом равновесии каждому процессу можно сопоставить обратный процесс, причем скорости их протекания одинаковы. А. Эйнштейн применил этот принцип и закон сохранения энергии при рассмотрении излучения и поглощения электромагнитных волн в случае черного тела. Из условия, что при равновесии полная вероятность испускания (спонтанного и вынужденного) фотонов равна вероятности поглощения фотонов той же частоты, Эйнштейн получил выведенную ранее Планком формулу (200.3).
Эйнштейн и Дирак показали, что вынужденное излучение (вторичные фотоны) тождественно вынуждающему излучению (первичным фотонам): оно имеет такие же частоту, фазу, поляризацию и направление распространения, как и вынуждающее излучение. Следовательно, вынужденное излучение строго когерентно с вынуждающим излучением, т. е. испущенный фотон неотличим от фотона, падающего на атом.
Испущенные фотоны, двигаясь в одном направлении и встречая другие возбужденные атомы, стимулируют дальнейшие индуцированные переходы, и число фотонов растет лавинообразно. Однако наряду с вынужденным излучением возможен и конкурирующий процесс — поглощение. Поэтому для усиления падающего излучения необходимо, чтобы число актов вынужденного излучения фотонов (оно пропорционально заселенности возбужденных состояний) превышало число актов поглощения фотонов (оно пропорционально заселенности основных состояний). В системе атомов, находящейся в термодинамическом равновесии, поглощение падающего излучения будет преобладать над вынужденным, т. е. падающее излучение при прохождении через вещество будет ослабляться.
Чтобы среда усиливала падающее на нее излучение, необходимо создать неравновесное состояние системы, при котором число атомов в возбужденных состояниях было бы больше, чем их число в основном состоянии. Такие состояния называются состояниями с инверсией населенностей. Процесс создания неравновесного состояния вещества (перевод системы в состояние с инверсией населенностей) называется накачкой. Накачку можно осуществить оптическими, электрическими и другими способами.
В средах с инверсными состоящими вынужденное излучение может превысить поглощение, вследствие чего падающий пучок света при прохождении через эти среды будет усиливаться (эти среды называются активными). В данном случае явление протекает так, как если бы в законе Бугера I=I 0 e–ax (см. (187.1)) коэффициент поглощения a, зависящий, в свою очередь, от интенсивности излучения, стал отрицательным. Активные среды поэтому можно рассматривать в качестве сред с отрицательным коэффициентом поглощения.
Впервые на возможность получения сред, в которых свет может усиливаться за счет вынужденного излучения, указал в 1939 г. российский физик В. А. Фабрикант, экспериментально обнаружив вынужденное излучение паров ртути, возбужденных при электрическом разряде. Открытие явления усиления электромагнитных волн и изобретенный способ их усиления (В. А. Фабрикант, М. М. Вудынский, ф. А. Бугаева; 1951) легли в основу квантовой электроники, положения которой позволили впоследствии осуществить квантовые усилители и квантовые генераторы света.
§ 233. Оптические квантовые генераторы (лазеры)
Практически инверсное состояние среды осуществлено в принципиально новых источниках излучения — оптических квантовых генераторах, или лазерах (от первых букв английского названия Light Amplification by Stimulated Emission of Radiation — усиление света с помощью вынужденного излучения). Лазеры генерируют в видимой, инфракрасной и ближней ультрафиолетовой областях (в оптическом диапазоне). Идея качественно нового принципа усиления и генерации электромагнитных волн, примененная в мазерах (генераторы и усилители, работающие в сантиметровом диапазоне радиоволн) и лазерах, принадлежит российским ученым Н. Г. Басову (р. 1922) и А. М. Прохорову (р. 1916) и американскому физику Ч. Таунсу (р. 1915), удостоенным Нобелевской премии 1964 г.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 332; Нарушение авторских прав?; Мы поможем в написании вашей работы!